?
参考答案:
?
需加入的试剂
分离装置
乙烷(乙烯)
③
d
溴苯(溴)
②
a
?苯(苯酚)
②
a
?乙醇(乙酸)
②
c
?苯(甲苯)
④
a
本题解析:略
本题难度:一般
2、选择题 下列实验方案不能达到预期目的的是(?)
选项
| 实验方案
| 预期目的
| A
| 将含有HCl的CO2气体通过饱和NaHCO3溶液
| 除去CO2中的HCl
| B
| 向X溶液中滴加盐酸酸化的BaCl2溶液
| 检验X溶液中是否含有SO42-
| C
| 向醋酸钠溶液中滴入酚酞试液,加热后若红色加深
| 证明盐类的水解是吸热的
| D
| 向含有少量苯酚的苯中加入NaOH溶液,振荡、静置、分液
| 除去苯中的苯酚
|
?
参考答案:B
本题解析:A、NaHCO3能吸收HCl,所以可用饱和NaHCO3溶液除去CO2中的HCl,正确;B、滴加盐酸酸化的BaCl2溶液生成白色沉淀,原溶液可能含SO42?,也可能含Ag+,不能达到预期目的;C、加热后若红色加深,说明CH3COO?水解程度增大,则证明盐类水解水解吸热,正确;D、苯酚能与NaOH反应生成苯酚钠和水,所以可用NaOH溶液除去苯中的少量苯酚,正确。
本题难度:简单
3、选择题 下列实验能达到预期目的的是(? )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用硝酸钡溶液鉴别SO42-与SO32-
⑤用溴水检验汽油中是否含有不饱和烃
A.①②③
B.①③④
C.②③⑤
D.②④⑤
参考答案:C
本题解析:①乙醇和乙酸生成乙酸乙酯和水的反应是可逆反应;②Cl2有毒,应该注意减少实验中的空气污染,制得的Cl2与足量的NaOH溶液反应则可减少实验中的空气污染;③将食醋与蛋壳反应产生的CO2气体通入澄清石灰水检验碳酸盐;④硫酸钡、亚硫酸钡都是白色沉淀;⑤不饱和烃可以使溴水褪色
本题难度:一般
4、填空题 硫酸铅广泛应用于制造蓄电池。利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下:
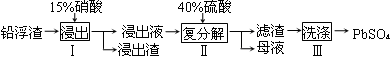
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9×10-5,Ksp(PbSO4)=1.6×10-8。
(1)已知步骤Ⅰ有NO产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的离子方程式?、?。
(2)步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,目的是?。
(3)母液可循环利用于步骤Ⅰ,其溶质主要是?(填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是?。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去?。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为?。
参考答案:(1)PbO+2H+=Pb2++H2O?(2分);
3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O?(2分)
(2)防止Ag被溶解进入溶液(或使Ag留在浸出渣中)(2分)
(3)HNO3(2分);浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率(2分)
(4)CaSO4杂质(2分)
(5)PbSO4+2e-=Pb+SO42-?(3分)
本题解析:(1)PbO与硝酸发生非氧化还原反应,离子方程式为PbO+2H+=Pb2++H2O;Pb与硝酸发生氧化还原反应,有NO气体放出,离子方程式为3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O?;
(2)Pb的活泼性比Ag强,Ag也可与硝酸反应,所以使Pb稍有剩余目的是防止Ag被溶解进入溶液(或使Ag留在浸出渣中);
(3)硫酸铅不溶于硝酸,所以硝酸铅与硫酸发生复分解反应,生成硫酸铅和硝酸,因此母液的主要溶质是HNO3;若母液中残留的SO42-过多,则在步骤Ⅰ中就有硫酸铅沉淀生成,随浸出渣排出,降低PbSO4的产率;
(4)浸出液中除含硝酸铅外还有硝酸钙,与硫酸反应有微溶的硫酸钙生成,所以洗涤的目的是除去CaSO4杂质;
(5)充电时铅蓄电池相当于电解池,阴极是硫酸铅发生还原反应生成Pb单质,电极反应式为PbSO4+2e-=Pb+SO42-?。
本题难度:一般
5、简答题 一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物
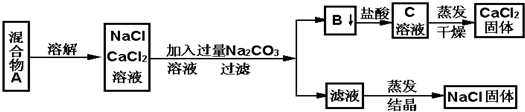
填空和回答下列问题
(1)B物质是______(写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是______.
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是______.
参考答案:(1)B物质是氯化钙和碳酸钠反应生成的,且不溶于水,由复分解反应可知B为碳酸钙,其化学式为CaCO3,故答案为:CaCO3;
(2)将此实验方法分离得到的NaCl,经分析含杂质,原因是前面加入的碳酸钠过量,没有除去,正确的设计方案应该是滤液蒸发结晶之前加盐酸,至不再产生气体为止,
故答案为:加入适量盐酸至不产生气体;
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和A的质量,故答案为:A.
本题解析:
本题难度:一般
|