时间:2017-09-25 16:59:44
1、填空题 (实验班)(13分)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) 0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) ?c (M+)= mol·L-1,c (H+) ?c (MOH) = mol·L-1。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH 7(填“>、<或=”)。
参考答案:17.(实验班) (1) > (2)9.9×10-7;1.0×10-8 (3)< c(Cl-)>c(M+)>c(H+)>c(OH- );(4)>7
本题解析:(1)等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,含有弱根离子的盐促进水电离,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol?L-1 HCl溶液中水电离出的c(H+),(2)根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7mol?L-1,根据质子守恒得 c(H+)-c(MOH)=c(OH-)=1.0×10-8mol?L-1,(3)室温下如果取0.2mol?L-1 MOH溶液与0.1mol?L-1 HCl溶液等体积混合,溶液中的溶质是MCl和MOH,测得混合溶液的pH<7,说明碱的电离程度小于盐的水解程度,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒知c(Cl-)>c(M+),盐中阴阳离子浓度大于氢离子和氢氧根离子浓度,所以溶液中各离子浓度由大到小的顺序为c(Cl-)>c(M+)>c(H+)>c(OH-),(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,氨水的浓度大于0.001mol/L,而盐酸的浓度为0.001mol/L,等体积混合后氨水过量,溶液显示碱性,溶液的pH>7,
考点:考查酸碱混合时的定性判断和有关PH值的计算。
本题难度:困难
2、选择题 对室温下pH、体积均相同的醋酸和盐酸溶液采取下列措施,有关叙述不正确的是
A.使温度都升高20℃后,两溶液的pH均不变
B.加水稀释10倍后,两溶液的pH均增大
C.加少量氢氧化钠钠晶体后,两溶液的pH均增大
D.加足量的锌充分反应后,两溶液中产生的氢气醋酸比盐酸多
参考答案:A
本题解析:盐酸时强电解质,醋酸是弱电解质,存在电离平衡CH3COOH CH3COO-+H+。加热促进电离,且水的离子积常数变大,因此溶液的pH是变化的,选项A不正确;稀释促进醋酸的电离,但醋酸的酸性还是降低的,选项B正确;氢氧化钠能中和溶液中的氢离子,所以溶液的酸性都是降低的,选项C正确;由于醋酸是弱酸,所以在pH相等的条件下,醋酸的浓度大于盐酸的,因此醋酸产生的氢气多,选项D也正确,答案选A。
CH3COO-+H+。加热促进电离,且水的离子积常数变大,因此溶液的pH是变化的,选项A不正确;稀释促进醋酸的电离,但醋酸的酸性还是降低的,选项B正确;氢氧化钠能中和溶液中的氢离子,所以溶液的酸性都是降低的,选项C正确;由于醋酸是弱酸,所以在pH相等的条件下,醋酸的浓度大于盐酸的,因此醋酸产生的氢气多,选项D也正确,答案选A。
本题难度:一般
3、选择题 下列过程表达式中,属于电离方程式的是
A.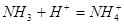
B.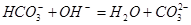
C.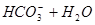
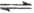
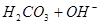
D.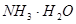
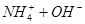
参考答案:D
本题解析:A、B是离子间发生化学反应不是电离,C是水解,D是电离。
考点:常见化学方程式发生的反应的类别。
本题难度:一般
4、选择题 下表是相同温度下三种酸的一些数据,下列判断正确的是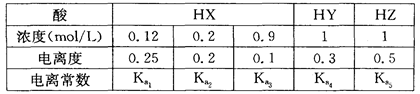
A.在相同温度下, >
>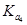 >
>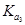
B.室温时,若在NaZ溶液中加水,则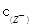 /
/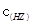 ·
· 的比值变小,若加少量盐酸,则比值变大
的比值变小,若加少量盐酸,则比值变大
C.等物质的量浓度的NaX、NaY和NaZ的混合溶液,则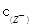 <
<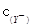 <
<
D.在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且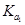 >
>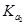 >
>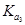 =0.01
=0.01
参考答案:A
本题解析:电离度是弱电解质达到电离平衡时已经电离的电解质分子浓度占电解质分子总浓度的百分比。它不仅以温度有关,还与电解质的浓度有关。电离平衡常数是弱电解质达到电离平衡时电离产生的各种离子浓度的乘积与未电离的电解质分子的浓度的比。它只与温度有关,而与浓度无关。A.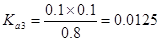 ;
;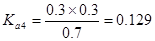 ;
;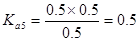 所以在相同温度下,
所以在相同温度下, >
>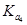 >
>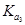 .正确.B.HZ为弱酸,所以NaZ为强碱弱酸盐,在加水的过程中平衡Z-+H2O
.正确.B.HZ为弱酸,所以NaZ为强碱弱酸盐,在加水的过程中平衡Z-+H2O HZ+OH-正向移动,促进了Z-的水解,Z-的水解程度增大,c(Z-)减小,c(HZ)、c(OH-)尽管平衡正向移动使它们的浓度有所增加,但是稀释作用远大于平衡移动增加的浓度,总的来说,浓度还是减小,所以c(Z-)/ c(HZ)·c(OH-)的比值变小。若加少量盐酸,发生反应:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)减小和c(OH-)减小,比值也变小。错误。C.在相同的温度下,在相同温度下,
HZ+OH-正向移动,促进了Z-的水解,Z-的水解程度增大,c(Z-)减小,c(HZ)、c(OH-)尽管平衡正向移动使它们的浓度有所增加,但是稀释作用远大于平衡移动增加的浓度,总的来说,浓度还是减小,所以c(Z-)/ c(HZ)·c(OH-)的比值变小。若加少量盐酸,发生反应:H++Z-=HZ,H++OH-=H2O。 c(HZ)增大,c(Z-)减小和c(OH-)减小,比值也变小。错误。C.在相同的温度下,在相同温度下, >
>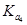 >
>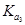 。电离平衡常数越大,等物质的量浓度的酸的酸性就越强。则其等物质的量浓度的NaX、NaY和NaZ的混合溶液,酸根离子的水解程度就越小,离子浓度就越大。则
。电离平衡常数越大,等物质的量浓度的酸的酸性就越强。则其等物质的量浓度的NaX、NaY和NaZ的混合溶液,酸根离子的水解程度就越小,离子浓度就越大。则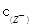 >
>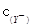 >
> 。D. 在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离产生的离子再重新结合形成电解质分子的几率就越小,电离度越大。但是电解质的电离平衡常数只与温度有关,而与浓度的大小无关。所以
。D. 在相同温度,从HX的数据可以说明:弱电解质溶液浓度越低,电离产生的离子再重新结合形成电解质分子的几率就越小,电离度越大。但是电解质的电离平衡常数只与温度有关,而与浓度的大小无关。所以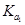 =
=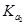 =
= 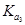 。错误。
。错误。
本题难度:简单
5、选择题 下列说法中正确的是
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.难溶于水的电解质不一定是弱电解质
C.氨气的水溶液可以导电,说明氨气是电解质
D.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
参考答案:B
本题解析:金属氧化物不一定是碱性氧化物,如过氧化钠,非金属氧化物不一定是酸性氧化物如一氧化碳,A错;电解质的强弱与物质的溶解性无关,电解质的强弱只看电解质在水中是否完全电离,若全电离则为强电解质,部分电离则为弱电解质,如碳酸钙虽然难溶于水但是溶于水的部分完全电离其属于强电解质,所以B正确;氨气水溶液能导电是因为氨气与水反应生成了一水合氨,一水合氨发生电离才可以导电,一水合氨属于电解质,但是氨气属于单质,既不是电解质也不是非电解质。C错;漂白粉用于自来水处理是因为漂白粉与空气中二氧化碳反应生成次氯酸,利用次氯酸的强氧化性达到杀菌消毒的目的,明矾是利用的铝离子的水解产生胶体,利用胶体的吸附性达到净化水的目的,二者原理不同,D错,所以选B。
本题难度:简单