时间:2017-09-25 16:45:40
1、选择题 在一定条件下,反应:2NO+O2 2NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是
2NO2在定容容器中发生,对该反应达到平衡的标志的描述中,错误的是
①混合气体的总分子数不再变化?②混合气体的颜色不再变化?③容器的总压强不再变化?④混合气体的总质量不再变化?⑤混合气体的密度不再变化?⑥单位时间内生成n mol的NO,同时消耗n mol的NO2 ?⑦反应的温度不再发生变化(绝热条件)
A.①②③⑦
B.④⑤⑥
C.①②④
D.③⑦⑤⑥
参考答案:B
本题解析:2NO+O2 2NO2两边的气体系数不相等的可逆反应。在恒容条件下,气体的总质量、密度为常量,不能做为平衡的判定标准,排除④⑤;⑥均表明的是逆反应速率,并不能表明正逆反应速率相等,排除。故答案为B
2NO2两边的气体系数不相等的可逆反应。在恒容条件下,气体的总质量、密度为常量,不能做为平衡的判定标准,排除④⑤;⑥均表明的是逆反应速率,并不能表明正逆反应速率相等,排除。故答案为B
本题难度:一般
2、选择题 在某密闭容器中投入X、Y进行如下反应:X(g)+2Y(g) 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足
2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足
A.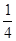 <
<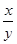 <
<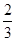
B.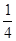 <
<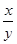 <
<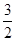
C.3<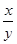 <4
<4
D.1<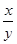 <3
<3
参考答案:B
本题解析:本题考查化学平衡计算,难度中等。
令参加反应的X的物质的量为n,
X(g)+2Y(g) ?2Z(g),
?2Z(g),
开始(mol):x? y? 0
转化(mol):n? 2n? 2n
平衡(mol):x-n? y-2n? 2n
平衡时反应物总物质的量与生成物总物质的量相等,所以有x-n+y-2n=2n,
解得n=(X+y)/5
反应物不能完全反应,所以有X>n,Y>2n,
即X>(X+y)/5?(1),Y>2(X+Y)/5?(2)
解(1)得:X/Y>1/4, 解(2)得:X/Y<3/2,
所以?1/4<X/Y<3/2
B正确,故本题选B.
本题难度:一般
3、填空题 (每空2分共10分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。若把体系温度降至800℃求得平衡常数K1=0.81,可以推知该反应的正反应为__________反应(填“吸热”、“放热”)。
(2)800℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应?进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
(1)0~10min 容器内气体的压强逐渐? ___________。(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是? ___第13min时曲线变化的原因可能是? __(填序号)
①增加Z的量? ②增加X的量? ③升温? ④降温? ⑤使用催化剂
参考答案:I.(1)?①?吸热?②?向正反应方向
II.(1)变大?(2)③⑤?(3)③
本题解析:I.(1)在830℃条件下,反应达到平衡时CO2的转化率为50%,则平衡时容器内物质的物质的量都是1mol,所以此时平衡常数是1。降低温度平衡常数减小,说明降低温度平衡向逆反应方向移动,所以正反应是吸热反应。
(2)因为 <0.81,所以向正反应方向进行。
<0.81,所以向正反应方向进行。
II.(1)根据图像可知,在0~10min时生成物的浓度增大,反应物的浓度减小,反应向正反应方向进行,即向体积增大的方向进行,所以压强增大。
(2)第7min时,物质的浓度变化程度变大,说明正逆反应速率都变大,所以答案只能是③⑤。
(3)第13min时,X的浓度增加,Z的浓度减小说明反应向逆反应方向减小。由于正反应是放热反应,所以是通过升高温度实现的。答案选③。
本题难度:一般
4、选择题 在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明可逆反应A(g) + 2B(g) C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
C(g) + D(g)(正反应为放热反应)已达到平衡状态的是
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.反应放出的热量
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项C可以说明。该反应是体积减小的,则压强也是始终减小的,所以当压强不再发生变化时可以说明。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,B不能说明。同样当反应放出的热量不再发生变化时,也可以说明,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应方程式灵活运用即可。
本题难度:一般
5、选择题 右图是恒温下某反应的化学反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
D.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
参考答案:D
本题解析:根据图像可以看出平衡状态II的反应速率大于平衡状态I,所以不可能是减小反应物浓度,因此D是错误的。答案选D。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般