时间:2017-09-25 16:45:40
1、选择题 在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是? (? )
H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是? (? )
参考答案:A
本题解析:在t1时达到平衡,I2%不变,t2时加热升温并保温,平衡向吸热的方向移动,即右移,I2%增大,到t3时又达到新平衡,I2%不变,故选A。
本题难度:简单
2、填空题 (15分)(一)一定温度下,在体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:2X(g) + Y(g)  ?a Z(g) + W(g)?△H =-QkJ·mol-1 (Q>0)
?a Z(g) + W(g)?△H =-QkJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值将?(填“增大”.“减小”或“不变”)。
(2)化学计量数a的值为?,该反应的熵变△S ?0(填“>”.“<”或“=”)。
(3)平衡后,若压缩容器体积,则再达到平衡后X的浓度将________(填“增大”、“减少”或“不变”)? X的转化率α= ??(用含Q.Q1的代数式表示)。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1?kJ的是?(稀有气体不参与反应)。
A.2 molX.1mol Y.1molAr
B.a molZ.1mol W
C.1 molX.0.5mol Y.0.5a molZ.0.5 mol W
D.4 molX.2mol Y
(二)若在相同温度下,将2 mol X和1 mol Y加入到容积固定不变的甲容器中,将2amol Z和2 mol W加入到容积可变的乙容器中,t1=5 min时两容器内均达到平衡状态,甲中c(Z)=1.5 mol/L。
请回答下列问题:
(1)5 min内,用X物质表示甲容器中的平均反应速率v(X)=________。
(2)保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙容器中Z的物质的量浓度c(Z)________(填“>”“<”或“=”)3 mol/L。
(3)保持温度不变,t2时分别向甲、乙中加入等质量的氦气后,下图中能表示甲中反应速率变化情况的是________,能表示乙中反应速率变化情况的是________。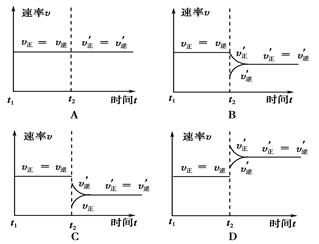
参考答案:(一)(1)减小?(2)1?,<?(3)增大? Q1/Q?(4)A
(二) (1)0.6 mol/(L·min)? (2) > (3)A ? C
本题解析:(一)(1)正反应放热,所以平衡后再升高温度,平衡向逆反应方向进行,平衡常数减小。
(2)正反应放热,所以平衡后再升高温度,平衡向逆反应方向进行。由于混合气体的平均相对分子质量减小,所以正反应一定是体积减小的,所以熵值是减小的,则a的值为1。
(3)压缩容器体积,则平衡向正反应方向进行,根据勒夏特列原理可知,X的浓度还是增大的。当反应达到平衡后,反应放出的热量为Q1 kJ,则根据热化学方程式可知,消耗X的物质的量是2Q1/Q,所以X的转化率是2Q1/Q÷2=Q1/Q。
(4)这是恒温恒容条件下的等效平衡,即无论如何进行配比,只要把一端按不可逆反应形式完全转化为另一端的物质后,相当于完全等同的起始量即可。所以选项A正确,B和C的状态等效,但放出的热量不是Q1。D中平衡不是等效的,方程式的热量大于2Q1,答案选A。
(二)(1)达到平衡状态,甲中c(Z)=1.5 mol/L,则消耗X是3.0mol/L,所以X的反应速率是3.0mol/L÷5min=0.6 mol/(L·min) 。
(2)反应是体积减小的,则压强也是减小的。所以保持温度不变,移动活塞P,使乙的容积和甲相等时,乙容器中压强是增大的,因此平衡向正反应方向进行,所以Z的浓度大于3.0mol/L。
(3)甲保持容器容积不变,则插入稀有气体,反应速率不变,平衡不移动;乙保持压强不变的,则插入稀有气体,容器容积增大,反应速率降低,平衡向逆反应方向进行,所以正确的答案选A和C。
本题难度:一般
3、简答题 [15分]甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 | 化学方程式 | 焓变△H (kJ/mol) | 活化能Ea (kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | 165.0 | 243.9 |
 CO2(g)+H2(g)的△H=?kJ/mol。
CO2(g)+H2(g)的△H=?kJ/mol。 CO(g)+3H2(g)的KP=?;
CO(g)+3H2(g)的KP=?;

参考答案:(15分)
(1)-41.2
(2)小于
(3)
增大
(4)系统内强放热的甲烷氧化反应为强吸热的蒸汽重整反应提供了所需的能量(其他合理答案均可)
(5)①B
②
(6)甲烷氧化程度过高,氢气和氧气反应(其他合理答案均可)
本题解析:(1)由反应CH4(g)+H2O(g) CO(g)+3H2(g) △H1="206.2" kJ/mol和CH4(g)+2H2O(g)
CO(g)+3H2(g) △H1="206.2" kJ/mol和CH4(g)+2H2O(g) CO2(g)+4H2(g) △H2="165.0" kJ/mol,再根据盖斯定律可知,反应CO(g)+H2O(g)
CO2(g)+4H2(g) △H2="165.0" kJ/mol,再根据盖斯定律可知,反应CO(g)+H2O(g) CO2(g)+H2(g)的△H=△H2-△H1="-41.2" kJ/mol;(2)开始时由于体系不能提供重整所需的热能,所以其氧化速率大于重整速率;(3)反应CH4(g)+H2O(g)
CO2(g)+H2(g)的△H=△H2-△H1="-41.2" kJ/mol;(2)开始时由于体系不能提供重整所需的热能,所以其氧化速率大于重整速率;(3)反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP=
CO(g)+3H2(g)的KP= ;由于该反应为吸热反应,所以,当温度升高时其平衡常数将增大;(4)该方法的先进之处为,用甲烷氧化反应所释放出来的大量热量来满足强吸热的蒸汽重整反应所需要的热量;(5)①分析图表,从左图中可找到0.9 Mpa,700℃时H2的物质的量分数大于65%,从右图中可找到0.9 Mpa,700℃时CO的物质的量分数小于10%,所以B项正确;②图像特点为开始由于体系温度未达到400℃,重整反应微弱,H2的含量几乎为0,后随着反应进行,体系的温度升高H2的含量也增大,到接近70%时达到最大值;(6)若甲烷氧化程度过高,若氧气的含量再增加,这时氢气将和氧气反应,导致氢气的物质的量分数下降。
;由于该反应为吸热反应,所以,当温度升高时其平衡常数将增大;(4)该方法的先进之处为,用甲烷氧化反应所释放出来的大量热量来满足强吸热的蒸汽重整反应所需要的热量;(5)①分析图表,从左图中可找到0.9 Mpa,700℃时H2的物质的量分数大于65%,从右图中可找到0.9 Mpa,700℃时CO的物质的量分数小于10%,所以B项正确;②图像特点为开始由于体系温度未达到400℃,重整反应微弱,H2的含量几乎为0,后随着反应进行,体系的温度升高H2的含量也增大,到接近70%时达到最大值;(6)若甲烷氧化程度过高,若氧气的含量再增加,这时氢气将和氧气反应,导致氢气的物质的量分数下降。
【考点定位】本题考查盖斯定律、化学平衡和图表分析能力。
本题难度:一般
4、选择题 已知热化学方程式:SO2(g)+ O2(g)  ?SO3(g)?△H =" ―98.32" kJ/mol,在容器中充入2molSO2?和1molO2充分反应,最终放出的热量为
?SO3(g)?△H =" ―98.32" kJ/mol,在容器中充入2molSO2?和1molO2充分反应,最终放出的热量为
A.196.64kJ
B.196.64kJ/mol
C.<196.64kJ
D.>196.64kJ
参考答案:C
本题解析:因为反应是可逆反应,2molSO2和1molO2充分反应不可能全部转化生成2molSO3,因此最终放出的热量要小于196.64kJ,答案是C。
本题难度:一般
5、选择题
aA(g) bB(g)
bB(g)
达平衡后,保持温度不变,将容器容积增加一倍,新平衡建立时,cB是原来的 60%,则(? )
A.平衡向正反应方向发生了移动
B.A 物质的转化率变小了
C.B 物质的质量分数增大了
D.a>b
参考答案:AC
本题解析:虚拟一种中间状态,假设平衡不移动,则新平衡建立时:cB是原来的 50%,而事实上cB是原来的 60%,这表明扩大容积平衡向生成 B 的方向——正反应方向发生了移动。
本题难度:一般