时间:2017-09-25 16:45:40
1、填空题 水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH="+131" kJ·mol-1
CO (g)+H2 (g) ΔH="+131" kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | v正=v逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ① |
| Ⅲ | 0.12 | 0.40 | 0.80 | v正<v逆 |
| Ⅳ | 0.12 | 0.30 | ② | v正=v逆 |
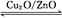 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。?
CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。?2、选择题 在一定温度下,可逆反应2A(g)+3B(g)  2C(g)达到平衡的标志是( )。
2C(g)达到平衡的标志是( )。
A.A的生成速率与C的分解速率相等
B.单位时间生成2n mol A,同时生成3n mol B
C.A、B、C的浓度不再变化
D.A、B、C的分子数之比为2∶3∶2
3、选择题 下列说法可以证明反应N2(g)+3H2(g) 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.N2、H2、NH3的分子数之比为1∶3∶2
D.1个N≡N键断裂的同时,有6个H—N键形成
4、选择题 利用原料气在合成塔中合成NH3,为加快正反应速率,且提高N2的转化率所采取的措施是?(?)。
A.加压
B.移走氨气
C.使用催化剂
D.充入N2
5、计算题 恒温下,将a?mol?N2与b?mol?H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13?mol,n(NH3)= 6?mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8?L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)n始:n平=
_________________。
(4)原混合气体中,a:b=_________。
(5)达到平衡时,N2和H2的转化率之比α(N2):α(H2)=________________。