时间:2017-09-25 16:25:52
1、选择题 用酸性KMnO4溶液不能达到预期目的的是
A.区别苯和甲苯
B.检验硫酸铁溶液中是否有硫酸亚铁
C.检验CH2=CHCHO中含碳碳双键
D.区别SO2和CO2
2、实验题 下列仪器中,根据物质的沸点不同分离物质时需要的是?(填编号)。
①容量瓶? ②普通漏斗? ③蒸馏烧瓶? ④天平? ⑤分液漏斗? ⑥滴定管?
⑦燃烧匙? ⑧温度计? ⑨干燥管
3、实验题 I.实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸?mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号):?.
①500mL量筒?②烧杯?③1000mL容量瓶?④500mL?容量瓶?⑤天平?⑥胶头滴管?⑦锥形瓶?⑧玻璃棒?⑨酸式滴定管
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是?。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.烧杯内的稀硫酸未冷却至室温就转移至容量瓶中
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
II. 某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验: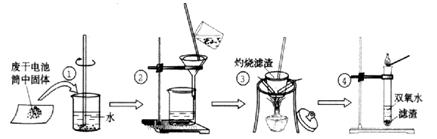
普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
⑴.操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为?(填化学式);
(2)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:(答案写在答题卷上)
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl— | 取少许滤液于试管中,加入? ? | 产生白色沉淀 | 含有Cl— |
| 2.检验NH4+ | 取少许滤液于试管中,加入? ? | ? ? ?? | 含有NH4+ |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ 4、选择题 分离以下三组混合溶液的正确方法依次是( ) 5、选择题 某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO、⑥SO中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下,下列结论正确的是? |