时间:2017-09-25 16:24:01
1、选择题 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合右图。则甲和X(要求甲和X能互换)不可能是 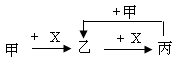
A.C和O2
B.SO2 和NaOH溶液
C.Cl2和Fe
D.CO2和石灰水
参考答案:C
本题解析:
A.C和O2 ? 乙是CO2?丙是CO
?B.SO2 和NaOH溶液?乙是NaHSO3?丙是Na2SO3
C.Cl2和Fe 乙是FeCl3?,乙转化到丙时甲和X不能互换
D.CO2和石灰水?乙是CaCO3?丙是CaHCO3。故选C。
点评:本题考查的是物之间的转化,学生只要熟悉物质间的转化,此类问题应该就没有问题的。
本题难度:简单
2、选择题 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 编号 | 甲 | 乙 | 丙 | 丁 ① Cu CuO CuSO4 Cu(NO3)2 ② Na2CO3 NaOH NaHCO3 CO2 ③ N2 NH3 NO NO2 ④ CH3CH2Br C2H5OH CH2=CH2 CH3CH3 |
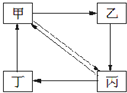
参考答案:B
本题解析:
本题难度:简单
3、简答题 已知?A、B?为气体,D?为液体,F?为固体.①、②反应为重要的工业反应,它们之间的转化?关系如图所示:
?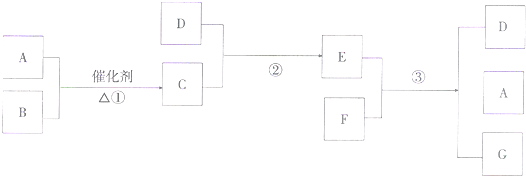
(1)F?有多种可能,请写出一种可能的情况,F?可能是(?化学式?)______反应③的化学方程式为______
(2)写出反应①的化学反应方程式______
(3)工业上制取?E?时,主要工业设备有______、______、______等,为了节约原料和避免环境污染,常常将______等气体循环使用.
参考答案:A、B都为气体,在催化剂条件下的反应中学阶段有SO2和O2以及N2和H2的反应,如是SO2和O2,则C为SO3,D为H2O,E为H2SO4,其浓溶液具有强氧化性,可与金属反应又能生成SO2,如是N2和H2的反应,C为NH3,对应水溶液不能和固体反应生成N2,则F可能为金属单质,如Cu等,可与浓硫酸反应,生成的G为CuSO4,
(1)由以上分析可知F可为Cu等金属,与浓硫酸反应的方程式为Cu+2H2SO4(浓)?△?.?SO2↑+CuSO4+H2O,
故答案为:Cu,Cu+2H2SO4(浓)?△?.?SO2↑+CuSO4+H2O;
(2)SO2和O2在催化剂条件下反应生成SO3,反应的方程式为2SO2+O2催化剂
本题解析:
本题难度:一般
4、简答题 图中B、F为单质,其他为化合物,它们之间存在如下转化关系(部分反应物、生成物及反应条件已略去).其中,A、C是工业上用途很广的两种重要化工原料,C的焰色反应为黄色,B为日常生活中常见的金属,H、G分子均具有正四面体结构,H是一种重要的能源.J是一种较好的耐火材料,K是极易溶于水的碱性气体,请回答下列问题:
(1)C中存在的化学键类型为______;G的电子式为______.
(2)反应②进行的条件______.
(3)反应①的离子方程式为______.
反应③的化学方程式为为______.
(4)向D溶液中通入K可生成M和另一种物质X,写出鉴定X中阳离子的实验方法和现象为______.
(5)碘和氯的原子序数之差为36,放射性131的原子核内中子数为______,碘在元素周期表中的位置为______.
(6)我国首创的海洋电池以B单质为负极,铂网为正极,海水为电解质溶液,空气中的氧气与B反应产生电流.该电池的正极反应式为______.
参考答案:H、G分子均具有正四面体结构,H是一种重要的能源,则H是甲烷,G是CCl4,A为HCl;B为日常生活中常见的金属,盐酸和B反应生成盐和氢气,F是单质,所以F是氢气,A、C是工业上用途很广的两种重要化工原料,C的焰色反应为黄色,所以C中含有钠元素,金属B能和盐酸反应也能和钠的化合物反应生成氢气,则B是铝,C是氢氧化钠,D是氯化铝,E是偏铝酸钠,氯化铝和偏铝酸钠反应生成氢氧化铝和氯化钠,M能加热生成J,所以M是氢氧化铝,J是一种较好的耐火材料,J是氧化铝,K是极易溶于水的碱性气体,则K是氨气.
(1)C是氢氧化钠,钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,G是CCl4,其电子式为: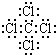
,故答案为:离子键、共价键;
;
(2)甲烷和过量氯气在光照条件下发生取代反应生成四氯化碳,故答案为:光照、过量Cl2;
(3)氯化铝和偏铝酸钠反应生成氢氧化铝和氯化钠,离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,电解熔融态的氧化铝来冶炼铝,同时生成氧气,反应方程式为:2Al2O3(熔融)?电解?.冰晶石4Al+3O2↑,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;2Al2O3(熔融)?电解?.冰晶石4Al+3O2↑;
(4)氯化铝和氨水反应生成氢氧化铝和氯化铵,要检验铵根离子,向含有铵根离子的溶液中加入可溶性碱,同时加热,用蓝色石蕊试纸检验氨气的存在,氨气能使蓝色石蕊试纸变红,
故答案为:取少量X溶液于试管中,用胶头滴管滴入NaOH溶液,将湿润的红色石蕊试纸置于试管口,加热试管,可观察到红色石蕊试纸变蓝;
(5)碘和氯的原子序数之差为36,则碘的原子序数=17+36=63,放射性131的原子核内中子数=131-53=78,碘位于第五周期第ⅦA族,故答案为:78;第5周期第ⅦA族;
(6)正极上氧气得电子发生还原反应,同时生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-(或3O2+6H2O+12e-=12OH-),故答案为:O2+2H2O+4e-=4OH-(或3O2+6H2O+12e-=12OH-).
本题解析:
本题难度:一般
5、推断题 已知有以下物质相互转化 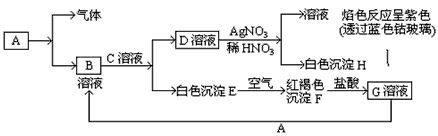
试回答:
(1)写出B的化学式? ,D的化学式? ?。
(2)写出由E转变成F的化学方程式? ? ?。
(3)写出用KSCN鉴别G溶液的离子方程式? ? ;
向G溶液加入A的有关离子反应方程式? 。
参考答案:(1)FeCl2;KCl
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
?(3)Fe3++SCN-===Fe(SCN)2+;2Fe3++Fe===3Fe2+
本题解析:
本题难度:一般