时间:2017-09-25 16:18:29
1、选择题 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )
A.A、B、D可能是钠及其化合物
B.A、B、D可能是镁及其化合物
C.A、B、D可能是铝及其化合物
D.A、B、D可能是非金属及其化合物
参考答案:B
本题解析:
本题难度:一般
2、简答题 由短周期元素组成的物质A-K,它们之间具有下图的转化关系:(图中反应条件已省略)已知:A是常见金属;B是常见非金属单质,常温为固体,其颜色常呈黑色或无色;E、F为常见气体,混合时点燃发生爆炸.
(1)写出:构成物质A的原子结构示意图:______;D的电子式:______;K的俗名:______;
(2)写出反应①各物质恰好完全反应的化学方程式:______;
(3)反应②中,若B和F按物质的量之比为4:3恰好完全反应,则生成物物质的量之比n(G):n(H)______.
参考答案:B是常见非金属单质,常温为固体,其颜色常呈黑色或无色;E、F为常见气体,混合时点燃发生爆炸,应为O2和H2的反应,则C为H2O,A是常见金属,与另一种固体在水中反应生成O2和H2,则该固体金属为Al,固体D为Na2O2,能与水和CO2反应,则G为CO2;再依据K能溶于水,说明K为Na2CO3,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳),C和氧气反应可生成CO2和CO,则H为CO;依据F(O2)与E反应生成C(水)可知E为氢气,
则A为Al,B为C,C为H2O,D为Na2O2,E为H2,F为O2,G为CO2,H为CO,K为Na2CO3,
(1)A为Al,原子核外有3个电子层,最外层电子数为3,原子结构示意图为
,D为Na2O2,为离子化合物,电子式为
,K为Na2CO3,俗称纯碱,
故答案为:
;
;纯碱;
(2)反应①为Al和Na2O2在水的反应,当恰好完全反应式,生成NaAlO2,
反应的方程式为2Na2O2+4Al+6H2O═4NaAlO2+6H2↑+O2,
故答案为:2Na2O2+4Al+6H2O═4NaAlO2+6H2↑+O2;
(3)B为C,F为O2,按物质的量之比为4:3恰好完全反应,反应的化学方程式为,4C+3O2?点燃?.?2CO2+2CO,生成物物质的量之比n(G):n(H)=1:1,
故答案为:1:1.
本题解析:
本题难度:一般
3、简答题 图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.其中A、G为非金属单质,A为黑色固体、G为气态;D、F都是大气污染物,主要来源于汽车尾气,而且D为红棕色.请回答以下问题:
(1)A元素在元素周期表中位于______周期______族,C的化学式是______.
(2)写出D与E反应转化为F和B的化学方程式______.
(3)在常温下,B的稀溶液也可与Cu反应生成F.此反应的离子方程式:______.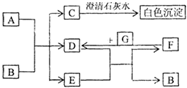
参考答案:D、F都是大气污染物,主要来源于汽车尾气,推断为但氧化物,而且D为红棕色判断为NO2,F为NO,G为O2;C在转化关系中C和澄清石灰水反应生成碳酸钙沉淀,证明C为气体为CO2,D(NO2)+E=F(NO)+B,推断E为H2O,B为HNO3,A、G为非金属单质,A为黑色固体、G为气态,判断A为C,证明C为二氧化碳;
(1)A元素为碳元素,在周期表中位置为第二周期第ⅣA族,C为CO2,故答案为:第二;ⅣA;CO2;
(2)D为NO2与EH2O反应转化为F(NO)和B(HNO3)的化学方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(3)常温下,B(HNO3)的稀溶液也可与Cu反应生成F(NO),反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
本题解析:
本题难度:一般
4、填空题 已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):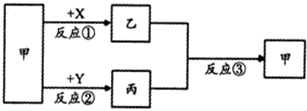
(1)若甲是可用于自来水消毒的黄绿色气体,X的水溶液通人二氧化碳能产生白色沉淀,则反应①的用途为______(填一种).
(2)若甲是空气中含量最高的气体,乙的密度小于丙,则一定条件下,反应③的化学方程式为______.
(3)若A是短周期元素,其主族数是周期数的两倍.若甲是单质,乙是氧化物且能使品红褪色,则反应③的化学方程式为______.
参考答案:甲、乙、丙中均含有元素A,乙和丙中都含有A元素,二者的反应为归中反应,
(1)甲是可用于自来水消毒的黄绿色气体,应为Cl2,X的水溶液通人二氧化碳能产生白色沉淀,可为Ca(OH)2,乙为Ca(Cl)2和CaCl2的混合物,乙和丙反应生成Cl2,反应①常用于制备漂白粉,
故答案为:漂白粉;
(2)甲是空气中含量最高的气体,应为N2,乙和丙中都含有N元素,二者的反应为归中反应,应为NH3和NO的反应,反应的方程式为4NH3+6NO?一定条件下?.?5N2+6H2O,
故答案为:4NH3+6NO?一定条件下?.?5N2+6H2O;
(3)A是短周期元素,其主族数是周期数的两倍,应为S元素,乙是氧化物且能使品红褪色,则应为SO2,则丙应为H2S,二者反应的方程式为SO2+2H2S=3S↓+2H2O,
故答案为:SO2+2H2S=3S↓+2H2O.
本题解析:
本题难度:一般
5、简答题 已知A为常见的金属单质,各物质有下图所示的关系:
(1)确定A、B、C、D、E、F的化学式:
A为__________,B为__________,C为__________,
D为__________,E为__________,F为__________。
(2)写出以下反应的化学方程式。
④___________________________________________________________________
⑤___________________________________________________________________
⑧___________________________________________________________________
参考答案:(1)A为Fe,B为Fe3O4,C为FeCl2,
D为FeCl3,E为Fe(OH)2,F为Fe(OH)3。
(2)写出以下反应的化学方程式。
④2FeCl2+ Cl2 = 2FeCl3
⑤Fe+2FeCl3 = 3FeCl2
⑧4Fe(OH)2+O2 +2H2O= 4Fe(OH)3
本题解析:推断题要找准题眼,红褐色沉淀,说明F是氢氧化铁,E在氧气条件下转化为氢氧化铁,说明E是氢氧化亚铁,同时也说明A是铁,B是黑色晶体,与盐酸反应生成亚铁和铁离子,说明B是四氧化三铁,C是氯化亚铁,D是氯化铁。
(1)根据上述的推断,可以确定A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3。
(2)④是由氯化亚铁转化为氯化铁,一般要加入氧化剂,但是产物只能是氯化铁,则只能加入Cl2。方程式:2FeCl2+ Cl2 = 2FeCl3
⑤是有氯化铁到氯化亚铁,应该加入还原剂,但是不能加铜等,因为产物只有氯化亚铁,则只能选择Fe。方程式:Fe+2FeCl3 = 3FeCl2
⑧氢氧化亚铁在空气中容易转化为氢氧化铁,由白色沉淀迅速转化为灰绿色,最后是红褐色沉淀氢氧化铁,方程式:4Fe(OH)2+O2 +2H2O= 4Fe(OH)3
点评:本题涉及的知识点主要是铁单质及其氧化物,二价铁、三价铁之间的 转化。比较简单。
本题难度:一般