时间:2017-09-25 16:18:08
1、填空题 (13分)氢气是一种清洁能源,可以通过多种方法制得。
(1) 工业上用水煤气法制氢气,有关化学方程式是:
反应一:C( s) + H2O(g)
s) + H2O(g)  CO(g) + H2(g) △H> 0
CO(g) + H2(g) △H> 0
反应二:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
①若反应一在t℃时达到化学平衡状态,则此温度下该反应的的平衡常数表达式
K = ;
②在427℃时将CO 和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状态,该反应的平衡常数是9,则CO的转化率是 ,用CO的浓度变化表示的反应率速v(CO)是 mol /(L·min)。
(2)利用电解饱和食盐水也可制得氢气,下图为电解食盐水的示意图: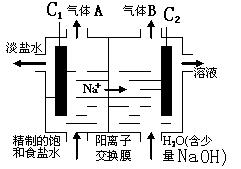
请回答:
① C1电极是 极(填“阴”或“阳”),C2电极的电极反应式是 。
②该电解反应的离子方程式是 ,
(3)通过下列方法也可以得到氢气。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
1molCH4(g)与H2O(g)反应生成CO2(g)和H2(g)的反应热是 kJ·mol-1。
参考答案:(13分)
(1)①K =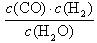
② 0.75 或 75% 、 7.5×10-4
(2)①阳、 2H+ + 2 e- = H2↑
② 2Cl- + 2H2O Cl2↑ + H2↑ + 2OH-
Cl2↑ + H2↑ + 2OH-
(3)+ 659.8
本题解析:略
本题难度:困难
2、选择题 下列叙述中,正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.晶体中只要有阴离子就一定有阳离子
D.金属原子失去电子变成稳定结构时吸收的能量越多,则该原子金属性越强。
参考答案:C
本题解析:A:硫离子与钾离子的核外电子排布完全相同,但前者只有还原性,后者只有氧化性;
B:Fe2+的核外最外层电子数为14;
D:金属原子失去电子变成稳定结构时吸收的能量越小,则越易失电子,则该原子金属性越强
本题难度:一般
3、填空题 已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) k J的热量。
参考答案:放出 ; 5.5
本题解析:断开1mol的H—H键、1 mol I—I需要吸收的能量是436kJ+151k J=587KJ;同时产生2mol的H—I键释放的能量是299k J×2=598KJ,放出的热量大于吸收的热量,所以该反应是放热反应,若产生1mol的HI需要放出的热量是(598KJ-587KJ)÷5.5KJ.
考点:考查反应热与键能的关系的知识。
本题难度:一般
4、选择题 下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O
B.NH3
C.Cl2
D.BCl3
参考答案:C
本题解析:A.在H2O?中H原子是2电子的稳定结构,O原子是8电子的稳定结构。错误。B.在NH3 H原子是2电子的稳定结构,N原子是8电子的稳定结构。错误。C.在Cl2中2个Cl原子通过一对共用电子对结合,2个Cl原子都是8电子的稳定结构。正确。D.在BCl3中B 原子与3个Cl原子通过三对共用电子对结合,3个Cl原子都是8电子的稳定结构,而B原子则是最外层6个电子,不是稳定结构。错误。
本题难度:一般
5、选择题 下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)4]2+中的Cu2+提供空轨道,H2O中的O原子提供孤对电子,两者结合形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛的应用
参考答案:B
本题解析:配位化合物中必定存在配位键,A正确;B不正确,在配位化合物中还含有其他化学键;C中水中的氧原子含有孤对电子,铜离子含有空轨道,可以形成配位健,C正确,D也水正确的,答案选B。
点评:该题是基础性试题的考查,主要是考查学生对配位健以及配位化合物的了解掌握情况,有利于培养学生的学习兴趣,调动学生的学习兴趣,提高学生的学习效率和应试能力。
本题难度:一般