时间:2017-09-25 16:18:08
1、填空题 短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为?;W的电子式 ?。
(2)已知:①2E → E-E; =-a kJ·mol-1?② 2A → A-A;
=-a kJ·mol-1?② 2A → A-A; =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E; =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式?。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g); =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | 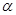 1 1 | 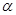 2 2 | 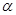 3 3 |
 ( A2)为?。
( A2)为?。
参考答案:(1)离子键、共价键(1分)(1分)
(2)H2(g)+Cl2(g)=2HCl(g);△H=(a+b-2c)kJ·mol-1(2分)
(3)①0.125mol·L-1·min-1(2分)?② 4(2分)?③ C(2分)?④ ABD(2分)
(4)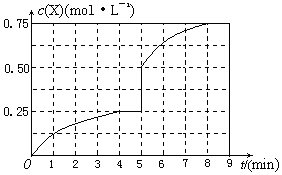 (2分)
(2分)
本题解析:A是周期表中原子半径最小的元素,即为H,B是形成化合物种类最多的元素,即为C
,C是自然界含量最多的元素,即为O,D是同周期中金属性最强的元素,即为Na,E的负一价离子与C的某种氢化物分子W含有相同的电子数,由于E的原子序数最大,则E即为Cl,因此W是双氧水。
(1)A、C、D形成的化合物是氢氧化钠,其中含有的化学键类型为:离子键、共价键;双氧水分子中含有极性键和非极性键,属于共价化合物,因此双氧水的电子式为 。
。
(2)已知①Cl-Cl→2Cl;△H=+a?kJ?mol-1、②2H→H-H;△H=-b?kJ?mol-1、③Cl+H→HCl;△H=-c?kJ?mol-1,所以依据盖斯定律可知H2(g)+Cl2(g)=2HCl(g)可以是①-②+③×2得到的,因此反应的焓变△H=-(2c-a-b)kJ/mol。
(3)①2H2(g)+CO(g) CH3OH(g)
CH3OH(g)
初始量:2?1? 0
变化量:1?0.5?0.5
平衡量:1?0.5?0.5
在该温度下,A2的平均反应速率v(A2)=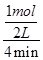 =0.125?mol?L-1?min-1;
=0.125?mol?L-1?min-1;
②化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该温度下,反应2H2(g)+CO(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=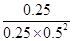 =4mol-2?L2;
=4mol-2?L2;
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则A、平衡时各种物质的浓度或物质的量不再发生变化,但它们之间的物质的量不一定相等或满足某种关系,因此容器内A2、BC、X的物质的量之比为2:1:1不能说明达到平衡状态,A不正确;B、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内气体的密度保持恒定不能说明反应达到平衡状态,B不正确;C、容器内A2气体的体积分数保持恒定可以说明反应达到平衡状态,C正确;D、2V正(A2)=V逆(BC)说明二者的反应速率方向是相反的,但不能满足反应速率之比是相应的化学计量数之比,不能说明反应达到平衡状态,D不正确,答案选C。
④A、投料2molH2、1molCO和1molCH4O建立的平衡是等效的,只是建立的方向不一样,所以α1+α2=1,故A正确;B、料2molH2、1molCO和1molCH3OH建立的平衡是等效的,反应2H2(g)+CO(g)?CH3OH(g)是放热的,放出的热量应该是Q1+Q2=a,故B正确;C、当氢气和一氧化碳的投料增加一倍,则压强会增大,导致化学平衡正向移动,移动的结果是反应物的转化率增大,即α3>α1,故C错误;D、投料2molH2、1molCO和1molCH3OH建立的平衡是等效的,所以P1=P2,当氢气和一氧化碳的投料增加一倍,则压强应是增大一倍,但是压强增大,导致化学平衡正向移动,移动的结果是压强比原来的2倍要小,即P3<2P1=2P2,故D正确;E、当氢气和一氧化碳的投料增加一倍,能量变化数值理论上也应该是原来的2倍,但是压强引起化学平衡正向,而正向放热,结果使得Q3>2Q1,故E错误。选ABD。
(4)将甲容器的体系体积压缩到1L,若在第8min 达到新的平衡时,则
2H2(g)+CO(g) CH4O(g)
CH4O(g)
初始量:2?1?0
变化量:1.5? 0.75?0.75
平衡量:0.5?0.25?0.75
所以达到平衡时,甲醇的物质的量浓度是0.75mol/L,在第5min时,由于体积减半,所以甲醇的浓度应该加倍,即为0.25mol/L×2=0.5mol/L,所以5-8min内,甲醇的物质的量浓度从0.5mol/L升高到0.75mol/L,如图所示: ?。
?。
本题难度:困难
2、选择题 氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时,所克服的微粒间作用力与氮化硼熔化所克服的微粒间作用力都相同的是(?)
A.NaCl和金刚石
B.晶体硅和SiO2
C.冰和干冰
D.SO2和SiO2
参考答案:B
本题解析:氮化硼熔化时克服的是共价键。A选项中,NaCl和金刚石熔化时分别克服的是离子键和共价键,不一致;C选项中,冰和干冰熔化时分别克服的是氢键和分子间作用力;D选项中,SO2和SiO2熔化时分别克服的是分子间作用力和共价键,故不正确;所以选B项。
点评:本题考查化学键的知识,根据所学知识即可作答,题目难度中等。
本题难度:简单
3、选择题 下列对H2(g)+Cl2(g)====2HCl(g) ΔH(298 K)=-184.6 kJ·mol-1的叙述正确的是
A.1分子H2和1分子Cl2反应,放出热量184.6 kJ
B.1 mol H2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ
C.在25℃、101 kPa的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出热量为184.6 kJ
D.在25℃、101 kPa的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)吸收热量为184.6 kJ
参考答案:C
本题解析:在热化学方程式中,计量数不再表示粒子数目,只表示物质的量,A项错误,B项叙述没有指明反应条件,ΔH<0,反应放热,D项错误,答案为C项。
本题难度:简单
4、填空题 (5分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1))氢气在燃烧时,放出大量热量,说明该反应是 热反应,这是由于反应物的总能量 生成物的总能量(填“大于”、“小于”或“等于”,下同);从化学反应的本质角度来看,由于断裂反应物中的化学键吸收的总能量 形成产物的化学键放出的总能量
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2g氢气燃烧时放出286kJ热量,而每千克汽油燃烧时放出的热量为46000kJ。试据此分析氢气作为能源代替汽油的优势
。
参考答案:(1)放?大于?小于(各1分)
(2)清洁能源,燃烧后无污染环境的物质生成;单位质量放出的热量多。(2分)
本题解析:考查化学反应中的能量变化。
(1)如果反应物的总能量高于生成物的总能量,反应就是放热反应,反之是吸热反应。如果从化学变化的本质分析,在化学反应中断键是吸热的,形成化学键是放热,如果断键吸收的能量高于形成化学键所放出的能量,反应就是吸热反应,反之是放热反应。
(2)氢气的燃烧产物是水,没有污染。其次根据所给的数据分析,单位质量的氢气的放出的热量多于汽油放出的热量。
本题难度:一般
5、选择题 下列说法中,不正确的是 &# 160; ( )
A.焓变为正值的反应都是吸热反应
B.放热的熵增加反应一定能自发进行
C.同一条件下,氨水在物质的量浓度不同的溶液中,其电离程度是不相同的
D.强电解质都是离子化合物,弱电解质都是共价化合物
参考答案:D
本题解析:略
本题难度:一般