时间:2017-09-24 01:20:28
1、选择题 将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
参考答案:C
本题解析:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故A错误; B、根据方程式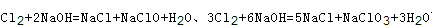 可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式
可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误; C、根据方程式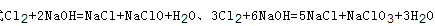 可知,氧化产物只有NaClO时,转移电子数最少,为
可知,氧化产物只有NaClO时,转移电子数最少,为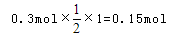 氧化产物只有NaClO3时,转移电子数最多,为
氧化产物只有NaClO3时,转移电子数最多,为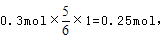 故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;
考点:考查氧化还原反应计算、根据方程式的计算等相关知识点
本题难度:一般
2、选择题 做好环境消毒工作是预防“禽流感”的重要措施,常用的一种消毒剂是ClO2,实验室可通过以下反应制得ClO2(未配平):KClO3+H2C2O4+H2SO4
参考答案:
本题解析:
本题难度:一般
3、选择题 将浓溴水加入苯中,经充分振荡、静置后、溴水层的颜色变浅,这是因为发生了
A.加成反应
B.萃取作用
C.取代反应
D.氧化反应
参考答案:C
本题解析:苯是一种很好的萃取剂,它能够溶解溴、碘等多种非金属单质,在实验室中我们如果要从溴水中提取溴,只要把苯等有机溶剂加入震荡,待分层后再分离即可得到单质溴。这里面是利用了苯是一种萃取剂的作用
本题难度:简单
4、选择题 以下反应不属于“同一价态的同种元素既被氧化又被还原”的是
A.硫代硫酸钠与稀硫酸
B.硫与热NaOH溶液
C.H2O2溶液中加入MnO2
D.KClO3与盐酸
参考答案:D
本题解析:A.硫代硫酸钠与稀硫酸反应为硫代硫酸钠中+2价S部分被还原为0价、部分被氧化为+4价,属于“同一价态的同种元素既被氧化又被还原”,故A不正确。B.硫与热NaOH溶液反应为0价S部分被还原为-2价、部分被氧化为+4价,属于“同一价态的同种元素既被氧化又被还原”,故B不正确。C. 溶液中加入MnO2,H2O2分生成解其中-1价O部分被还原-2价、部分被氧化为0价,属于“同一价态的同种元素既被氧化又被还原”,故C不正确。D.KClO3与盐酸反应为KClO3中+5价Cl与HCl中-1价Cl生成0价的Cl2。故D正确。
考点:了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。
点评:本题考查氧化还原反应的类型,特别是歧化反应与归中反应。氧化还原反应中同种元素价态变化的规律为同“可分可合,不交叉”,化合价“分”即为歧化反应,化合价“合”即为归中反应。
本题难度:一般
5、选择题 如果3.2 g XO2中含有0.1 mol的氧原子,则X的相对原子质量为
A.32
B.16
C.48
D.8
参考答案:A
本题解析:本题考查物质的量、摩尔质量及构成物质的粒子数之间的关系,可有多种解法。
设X原子的摩尔质量为M,
解法一:关系式法
XO2? —? 2O
M+16×2 g? 2 mol
3.2 g? 0.1 mol
M=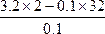 =32 g·mol-1
=32 g·mol-1
解法二:物质的量之比法
n(X)∶n(O)= 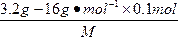 ∶0.1 mol=1∶2
∶0.1 mol=1∶2
M=32 g·mol-1。
解法三:公式法
M==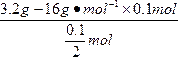 =32 g·mol-1
=32 g·mol-1
本题难度:简单