时间:2017-09-24 01:09:20
1、选择题 下列各项说法中,不正确的是? (? )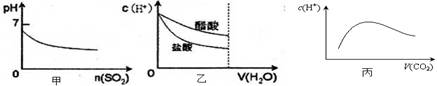
A.甲是向溴水通入SO2气体时,pH与SO2物质的量的关系图
B.乙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图
C.常温常压下,将2b mol CO2气体通入1L bmol·L-1的NaOH溶液中,随着CO2气体的通入,溶液中由水电离出的c(H+)有如丙图变化关系
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)>c(NO3-)
参考答案:D
本题解析:A、溴水与二氧化硫反应生成溴化氢和硫酸,pH降低,A正确;B、盐酸是强酸,醋酸是弱酸,存在电离平衡,稀释促进电离,所以稀释相同的倍数时盐酸的pH变化大,B正确;C、二氧化碳与氢氧化钠反应生成碳酸钠,二氧化碳过量又生成碳酸氢钠。根据数量关系可知,最终得到的是碳酸氢钠和碳酸的混合液。氢氧化钠是强碱,抑制水的电离,而碳酸钠、碳酸氢钠均水解促进水的电离,但碳酸氢钠的水解程度小于碳酸钠的水解程度,因此图像不符合,C不正确;D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中根据电荷守恒可知c(Na+)+ c(H+)=c(OH-)+ c(Cl-)+>c(NO3-),c(H+)=c(Cl-),所以溶液中:c(Na+)>c(NO3-),D正确,答案选D。
本题难度:一般
2、选择题 在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是(?)
参考答案:B
本题解析:pH均等于2的盐酸和醋酸溶液,起始氢离子浓度相同,但醋酸为弱酸,醋酸的浓度远大于盐酸的浓度,与等量的Na反应时,醋酸的电离平衡正向移动,醋酸中氢离子浓度大于盐酸中氢离子浓度,醋酸反应速率快;由题给数据结合反应方程式判断,醋酸远过量,盐酸恰好反应。A、醋酸与Na反应生成醋酸钠溶液,因醋酸根离子水解显碱性,但醋酸远过量,反应后溶液显酸性,溶液的pH<7,盐酸与Na恰好完全反应生成氯化钠,则反应后溶液的pH=7,错误;B、因盐酸与Na恰好完全反应,则反应后溶液的pH=7,醋酸与Na反应生成醋酸钠溶液,但醋酸远过量,溶液显酸性,所以溶液的pH<7,正确;C、因Na的质量相同,则与盐酸恰好完全反应,醋酸过量,生成氢气相同,错误;D、因Na的质量相同,则与盐酸恰好完全反应,醋酸过量,生成氢气相同,且醋酸中氢离子浓度大于盐酸中氢离子浓度,则醋酸中反应速率快,错误。
本题难度:一般
3、选择题 超酸是指酸性比普通无机酸强l06~1010倍的酸,魔酸(HSO3F-SbF5)是已知超酸中最强的,许多物质如
H2SO4在魔酸中可获得质子。则硫酸溶于魔酸中所表现出的这种性质是
[? ]
A.碱性
B.酸性
C.还原性
D.氧化性
参考答案:A
本题解析:
本题难度:一般
4、简答题 Ⅰ.已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
| ① | HF | Ka=6.8×10-4mol?L-1 ② CH3COOH Ka=1.7×10-5mol?L-1 ③ HCN Ka=6.2×10-10mol?L-1 ④ H2CO3 Ka1=4.4×10-7mol?L-1 Ka2=4.7×10-11mol?L-1 |
参考答案:Ⅰ.(1)四种酸中HF的电离平衡常数最大,则HF酸最强,HCN的电离平衡常数最小,则HCN酸性最弱,
故答案为:HF;HCN;
(2)碳酸为二元弱酸,分步电离,以第一步电离为主,电离方程式为H2CO3?HCO3-+H+、HCO3-?CO32-+H+,
故答案为:H2CO3?HCO3-+H+;HCO3-?CO32-+H+;
(3)酸性强弱HF>H2CO3>HCN>HCO3-,可发生反应生成NaF和CO2,反应的方程式为2HF+Na2CO3═2NaF+H2O+CO2↑,足量的CO2通入NaCN溶液中,发生的反应方程式为NaCN+H2O+CO2═HCN+NaHCO3,
故答案为:2HF+Na2CO3═2NaF+H2O+CO2↑;NaCN+H2O+CO2═HCN+NaHCO3;
Ⅱ.(1)加水稀释促进一水合氨电离,加入浓氨水,一水合氨浓度增大平衡正向移动,加入浓硫酸,和氢氧根离子反应促进一水合氨电离,所以促进一水合氨电离的是ABD;
加入少量氢氧化钠,c(OH-)增大抑制一水合氨电离,加入少量氯化铵,c(NH4+)增大,抑制一水合氨电离,所以抑制一水合氨电离的是CE;
故答案为:ABD;CE;
(2)向溶液中加入浓氨水,促进一水合氨电离,溶液中c(NH4+)、c(OH-)都增大;
向溶液中加入水,促进一水合氨电离,但铵根离子或氢氧根离子增大的倍数小于溶液体积增大的倍数,所以c(NH4+)、c(OH-)都减小;
故答案为:A;B;
(3)向溶液中加入氯化铵,铵根离子浓度增大抑制一水合氨电离,则氢氧根离子浓度减小;向溶液中加入氢氧化钠固体,溶液中氢氧根离子浓度增大抑制一水合氨电离,则铵根离子浓度减小,
故答案为:E;C.
本题解析:
本题难度:简单
5、选择题 常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是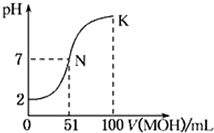
A.HA为一元强酸
B.N点水的电离程度小于K点水的电离程度
C.随着MOH溶液的滴加,比值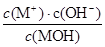 不变
不变
D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L
参考答案:B
本题解析:0.01mol?L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒计算K点c(MOH)和c(M+)的和。A、0.01mol?L-1 HA溶液中pH=2,则HA是强酸,故A正确;B、N点溶液呈中性,K点溶液呈碱性,碱性溶液抑制水电离,所以N点水的电离程度大于K点水的电离程度,故B错误;C、N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,温度不变,则弱碱的电离常数不变,因此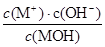 ,C正确;D、在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)+c(M+)=0.01mol?L-1,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),c(MOH)+c(OH-)-c(H+)=c(M+)-c(A-)+c(MOH)=0.01mol?L-1-0.005mol?L-1=0.005mol?L-1,故D正确,故选D。
,C正确;D、在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)+c(M+)=0.01mol?L-1,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),c(MOH)+c(OH-)-c(H+)=c(M+)-c(A-)+c(MOH)=0.01mol?L-1-0.005mol?L-1=0.005mol?L-1,故D正确,故选D。
本题难度:一般