时间:2017-09-24 01:04:35
1、简答题 金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G,它们都是中学阶段常见的化学物质,它们之间存在下图所示的转化关系(图中有些反应的产物和反应的条件没有全部标出):
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:丙______,G______.
(2)反应③的化学方程式为______.
(3)反应⑤的离子方程式为______.
参考答案:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得盐酸.氢氧化钠与物质F反应生成红褐色沉淀G是Fe(OH)3,故物质F中含有Fe3+,由转化关系HCl盐酸
本题解析:
本题难度:一般
2、填空题 如图表示常见元素单质及化合物相应关系,某些生成物已略去。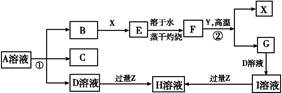
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分。请回答下列问题:
(1)D的电子式?;H为?(填化学式)。
(2)完成下列方程式:
①空气中含量最高的气体与C反应的化学反应方程式?;
②反应②的化学反应方程式?;
③足量B通入H溶液的离子反应方程式?。
参考答案:(1)Na+ H]-? NaHSO3
H]-? NaHSO3
(2)①N2+3H2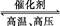 2NH3
2NH3
②2Al+Fe2O3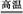 2Fe+Al2O3(或2Al+3CuO
2Fe+Al2O3(或2Al+3CuO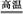 3Cu+Al2O3)
3Cu+Al2O3)
③Cl2+HSO3-+H2O=2Cl-+SO42-+3H+
本题解析:氯碱工业基础反应为电解饱和食盐水的反应,反应方程式为2NaCl+2H2O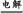 2NaOH+H2↑+Cl2↑,故D为NaOH;又因为B能与金属X反应,故B、C分别为Cl2、H2;联想Cl2能与Fe、Cu、Na等反应,若X为Fe(Cu),则E为FeCl3(CuCl2),F为Fe2O3(CuO);反应②为金属与金属氧化物在高温下发生的反应,应该是铝热反应,可推测Y为Al,则G为Al2O3,则I为NaAlO2。形成酸雨的主要气体为SO2和NOx,过量二氧化硫气体通入氢氧化钠溶液生成NaHSO3,NaAlO2溶液中通过量SO2气体也生成NaHSO3。若Z为NO2,NO2通入NaOH溶液生成NaNO3、NaNO2和H2O,题中H溶液中溶质只有一种,所以Z只能为SO2,H为NaHSO3。空气中含量最高的气体为N2,N2与H2反应方程式为N2+3H2
2NaOH+H2↑+Cl2↑,故D为NaOH;又因为B能与金属X反应,故B、C分别为Cl2、H2;联想Cl2能与Fe、Cu、Na等反应,若X为Fe(Cu),则E为FeCl3(CuCl2),F为Fe2O3(CuO);反应②为金属与金属氧化物在高温下发生的反应,应该是铝热反应,可推测Y为Al,则G为Al2O3,则I为NaAlO2。形成酸雨的主要气体为SO2和NOx,过量二氧化硫气体通入氢氧化钠溶液生成NaHSO3,NaAlO2溶液中通过量SO2气体也生成NaHSO3。若Z为NO2,NO2通入NaOH溶液生成NaNO3、NaNO2和H2O,题中H溶液中溶质只有一种,所以Z只能为SO2,H为NaHSO3。空气中含量最高的气体为N2,N2与H2反应方程式为N2+3H2 2NH3。反应②化学方程式为:2Al+Fe2O3
2NH3。反应②化学方程式为:2Al+Fe2O3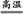 2Fe+Al2O3或2Al+3CuO
2Fe+Al2O3或2Al+3CuO 3Cu+Al2O3。Cl2具有氧化性,HS
3Cu+Al2O3。Cl2具有氧化性,HS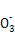 具有还原性,足量Cl2通入NaHSO3溶液中发生氧化还原反应,离子方程式为Cl2+HSO3-+H2O=2Cl-+SO42- +3H+。
具有还原性,足量Cl2通入NaHSO3溶液中发生氧化还原反应,离子方程式为Cl2+HSO3-+H2O=2Cl-+SO42- +3H+。
本题难度:一般
3、填空题 (16分)A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。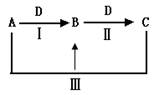
(1)若A是一种强碱,C为厨房中的用品。
①反应Ⅲ的离子方程式是__________________________________。
②下列有关B、C的说法正确的是?
A.向B的饱和溶液中通入D,将有晶体析出
B.可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液
C.分别取等质量的B、C两种固体与足量盐酸反应C产生气体多
D.取a克B、C的混合物充分加热,固体质量减重b克,由此可计算出混合物中B的质量分数
E.取a克B、C的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰完全吸收,增重b克, 由此可计算出混合物中B的质量分数
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是__________________________________。
②向沸水中逐滴加入5~6滴B的饱和溶液,继续煮沸至溶液呈红褐色,该反应的化学方程式为:?。区分该分散系与其它分散系最本质的特征是?。
⑶若常温下A、C是气体,B是固体。
①反应Ⅲ的化学方程式是__________________________________.
有两瓶经过C气体和(2)中的A气体漂白的品红溶液,如何通过简单实验进行鉴别??
?
?。
③在BaCl2溶液中通入C气体,未见沉淀生成,若先通入下列的另一种气体,再通入C;或者向通入C气体的BaCl2溶液中加入下列物质,可以看到沉淀的有_______(填序号)。
A、Cl2? B、NH3? C、HCl? D、CO2?E、KNO3?
参考答案:(16分,每空2分)(1)①HCO3-+OH-="==" H2O+CO32-?②ACD
(2)①Cl2+2Fe2+===2Cl-+2Fe3+? ②FeCl3+3H2O ?Fe(OH)3(胶体)+3HCl
?Fe(OH)3(胶体)+3HCl
分散质微粒直径在1~100 nm之间。
(3)①SO2+2H2S===3S↓+2H2O
②分别取少量经漂白的品红溶液于试管中,加热,恢复红色的是经过C气体漂白的品红溶液,不能恢复红色的是经过(2)中的A气体漂白的品红溶液
③ABE
18、
本题解析:本题为开放性试题,由转化关系,我们很容易想到,①连续氧化、②碱、正盐、酸式盐等。(1)A为强碱,为NaOH、Na2CO3、NaHCO3;(2)D红棕色颜料为Fe2O3,故A:Cl2、D:Fe;(3)C气体漂泊品红,并与Cl2的原理不一样,为SO2,改组为连续氧化得到:H2S→S→SO2。
本题难度:一般
4、简答题 下列各物质的相互转变中,反应①、②是工业上重要的反应,A的相对分子质量为120.X被人体吸入会与血红蛋白结合而使人中毒,Y会造成温室效应,D会形成酸雨,E是常见的金属,F分子的结构与Y分子的结构相似,且F的相对分子质量为60.
回答下列问题:
(1)写出下列物质的化学式:A______,E______.
(2)反应①的化学方程式为______.
(3)反应②的化学方程式为______.
(4)写出F的结构式______.
(5)Y与H2在一定条件下可生成多种物质,既可获得经济效益,也可减轻对环境的污染.
①若G是一种燃料,其相对分子质量与B的相对分子质量相等,则G的结构简式为______.
②若G是Y与H2按1:3的比例反应而得的烃类有机物,则G可能是______.
参考答案:Y会造成温室效应,Y为CO2,D会形成酸雨,为SO2,X被人体吸入会与血红蛋白结合而使人中毒,结合转化②可知X为CO,E是常见的金属,E可能是Fe,C为铁的氧化物,结合反应①及A的相对分子质量为120可知,反应①为FeS2+O2→Fe2O3+SO2,A为FeS2,B为O2,C为Fe2O3,符合转化关系;
F分子的结构与Y分子的结构相似,F的相对分子质量为60,由反应③CO+SO2→CO2+F,F为O═C═S;
(1)由上述分析可知,A为FeS2,E为Fe;
故答案为:FeS2,Fe;
(2)反应①是FeS2与O2反应生成氧化铁与二氧化硫,反应方程式为:4FeS2+11O2?高温?.?2Fe2O3+8SO2;
故答案为:4FeS2+11O2?高温?.?2Fe2O3+8SO2;
(3)反应②是一氧化碳与氧化铁反应生成铁、二氧化碳,反应方程式为:Fe2O3+2CO?高温?.?2Fe+3CO2;
故答案为:Fe2O3+2CO?高温?.?2Fe+3CO2;
(4)F分子的结构与Y分子的结构相似,F的相对分子质量为60,由反应③CO+SO2→CO2+F,F为O═C═S;
故答案为:O═C═S;
(5)由转化关系CO2+H2→G+H2O,
①若G是一种燃料,其相对分子质量与O2的相对分子质量相等,则G为CH3OH;
故答案为:CH3OH;
②若G是CO2与H2按1:3的比例反应而得的烃类有机物,根据元素守恒可知G中C原子与H原子数目为1:2,故G可能为C2H4;
故答案为:C2H4.
本题解析:
本题难度:一般
5、填空题 (16分)煤的“气化”是使煤变成清洁能源的有效途径之一,其主要反应为:? C+H2O CO+H2甲酸苯丙酯(F)是生产香料和药物的重要原料。下面是用煤为原料合成甲酸苯丙酯的路线图(部分反应条件和生成物已略去),其中D的分子式为C9H10O,且能发生银镜反应。
CO+H2甲酸苯丙酯(F)是生产香料和药物的重要原料。下面是用煤为原料合成甲酸苯丙酯的路线图(部分反应条件和生成物已略去),其中D的分子式为C9H10O,且能发生银镜反应。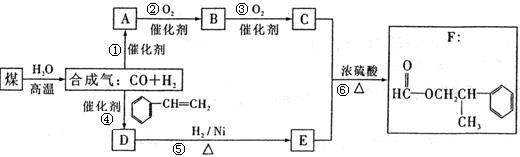
根据上述转化关系回答下列问题:
(1)写出A、D的结构简式:A:?,D:?。
(2)D→E的反应类型为?。
(3)B与新制Cu(OH)2浊液反应也能生成C,写出其化学方程式:
?
(4)写出C与E反应生成F的化学方程式?。
(5)上图中所标注的6个反应,其中有4个原子利用率达到100%,请写出这4个反应?(填写反应序号)。
(6)F有多种同分异构体,写出满足下列条件的两种同分异构体的结构简式。
①属于酯类,且能发生银镜反应。②苯环上的一氯取代物只有两种结构。③分子结构中只有两个甲基。
?、?。
参考答案:(1)CH3OH;
(2)还原
(3)HCHO+2Cu(OH)2 HCOOH+Cu2O↓+2H2O
HCOOH+Cu2O↓+2H2O
(4)HCOOH + HOCH2CH(CH3)-C6H5 HCOOCH2CH(CH3)
HCOOCH2CH(CH3) -C6H5 +H2O
-C6H5 +H2O
(5)①③④⑤
(6)CH3-CH(CH3)-C6H5-OOCH;CH3-C6H5-CH(CH3)-OOCH
本题解析:略
本题难度:简单