时间:2017-09-24 00:50:26
1、填空题 (12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.用于合成氨的工业煤气中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)钴原子在基态时核外电子排布式为?。
(2)下列有关分子结构的说法正确的是?。
A.C2H4分子中有5个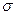 键处1个
键处1个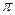 键
键
B.COS分子(结构如右图)中键能C=O>C=S
C.H2S分子呈V形结构
D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是?。
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:Cs2>COS >CO2
>CO2
C.相同压强下沸点:C2H 5SH>C2H5OH
5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4) -ZnS的晶胞结构如右图,晶胞中S2-数目为:?个。
-ZnS的晶胞结构如右图,晶胞中S2-数目为:?个。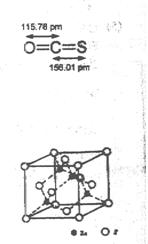
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于?。
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]·8H2O,中心原子的配位数为?。
B.烃醛结合反应有机合成中颇为重要,绿色催化剂的固体铌酸酸倍受研究者关注。铌酸具有较高的催化活性及稳定性。反应原理如下: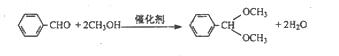
实验方法是在25mL烧瓶中加入铌酸、10mL甲醇和 0.5mL苯甲醛,在回流状态下反应2h,反应的产率和转化率均非常高。
(1)采用回流反应2h的目的是?。
(2)在反应中甲醇需过量,其原因是?。 ?(3)不同铌酸用量对产率和转化率影响,如下表:
?(3)不同铌酸用量对产率和转化率影响,如下表:
| 铌酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 产率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 转化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
| 序号 | 醛 | 醇 | 转化率% | 产率% |
| 1 | 邻羟基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 邻羟基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 邻氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 间硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 邻硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 对硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |
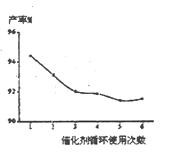
2、填空题 在18世纪40年代以前,生产硫酸最古老的方法是:以绿矾(FeSO4·7H2O)为原料在蒸馏中煅烧,然后再冷凝至室温,得到一种液体,称之为“绿矾油”。
(1)蒸馏釜所产生的气体中含有的成分是________________________。
(2)绿矾油的成分是________________________。
(3)绿矾油质量分数是________________________。
(4)留在蒸馏釜中的物质是________________________。
3、选择题 高效肥料一般是指含营养成分在30%以上的化肥。下列不属于高效肥料的是( )。
A.尿素
B.硝酸铵
C.液氨
D.氯化铵
4、实验题 (10分)氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空: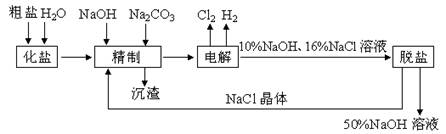
(1)在电解过程中,与电源正极相连的电极上电极反应为__________________,与电源负极相连的电极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_________
_______________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_________。
a. Ba(OH)2? b. Ba(NO3)2? c. BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________(选填a、b、c)
a. 先加NaOH,后加Na2CO3,再加钡试剂?
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________、冷却、_________(填写操作名称)除去NaCl。
5、填空题 海水中有丰富的化学资源,从海水中可提取多种化工原料,下图是海水综合利用——合成氨——纯碱的联合生产工艺流程:
(1)写出反应器中发生反应的化学方程式: 。
(2)分离器中进行的操作名称是 ,图中操作①是 。
(3)产品Ⅱ是 (填化学 式)。
式)。
(4)写出合成氨厂里用天然气和水蒸气在催化剂和高温下反应制备原料气H2的化学方程式: 。
(5)设计用卤水和石灰及其他必要试剂提取镁的过程:(用化学方程式表示)。