时间:2017-09-24 00:45:03
1、填空题 某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案: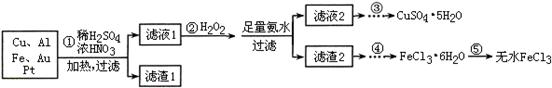
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
参考答案:(1)Cu + 4H+ + 2NO3? = Cu2+ +2NO2↑+ 2H2O 3Cu+8H++2NO3? 3Cu2++2NO↑+4H2O (任写一个给2分)
3Cu2++2NO↑+4H2O (任写一个给2分)
(2)将Fe2+氧化成Fe3+ (1分) Fe(OH)3、Al(OH)3 (各1分共2分)
(3)FeCl3易水解:FeCl3+3H2O 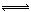 Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。(2分)
Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。(2分)
(4) 5 (2分)
(5)溶液由蓝色褪为无色且半分钟内不恢复原色 (2分) 83.3% (2分)
本题解析:(1)浓硝酸与稀硫酸混合后,可能为浓硝酸也可能为稀硝酸,所以离子方程式为:Cu + 4H+ + 2NO3? = Cu2+ +2NO2↑+ 2H2O或3Cu+8H++2NO3? 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
(2)H2O2具有强氧化性,所以H2O2的作用是将Fe2+氧化成Fe3+;加入足量氨水,Fe3+、Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀,所以滤渣2为Fe(OH)3、Al(OH)3。
(3)FeCl3为强酸弱碱盐,容易发生水解反应:FeCl3+3H2O 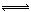 Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
(4)c2(OH?)?c(Cu2+)= Ksp[Cu(OH)2],代入数据可求出c(OH?)=1.0×10-9mol?L?1,pH=-lgc(H+)=-lg【Kw÷c(OH?)】=5。
(5)Cu2+把I?氧化为I2,加入淀粉溶液变蓝,用Na2S2O3标准溶液滴定,达到滴定终点时,Na2S2O3与I2恰好完全反应,所以达到滴定终点的依据是:溶液由蓝色褪为无色且半分钟内不恢复原色;实验3所测数据明显大于其他3组数据,说明实验3出现了实验错误,应舍去,根据其他3组数据求出平均值,根据2Cu2++4I-= 2CuI↓+I2和I2+2S2O32-= 2I-+S4O62-可得对应关系:S2O32- ~ Cu2+,所以n(CuSO4?5H2O)=n(Cu2+)=n(S2O32- )=0.080 mol·L-1 ×(25.00+25.02+24.98)/3L=0.002mol,所以此产品中CuSO4·5H2O的质量分数为:0.002mol×250g/mol×5÷3.00g×100%=83.3%
考点:本题考查化学流程的分析、化学方程式的书写、盐类水解的应用、pH的计算、氧化还原反应滴定及计算。
本题难度:困难
2、选择题 物质的量浓度相同的下列溶液中,NH4+浓度最大的是
A.NH4Cl
B.NH4HSO4
C.CH3COONH4
D.NH4HCO3
参考答案:B
本题解析:铵根离子水解显酸性,B.NH4HSO4中氢离子抑制其水解,C.CH3COONH4D.NH4HCO3中阴离子促进其水解,A中正常水解,浓度最大的为B
本题难度:一般
3、填空题 (6分)某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A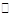 H++HA-,HA-
H++HA-,HA-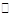 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合
据此,填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 ;
(2)c(H2A)最大的是 ,最小的是 ;
(3)c(A2-)最大的是 ,最小的是 。
参考答案:(1)A , D (2)C, D (3)D,A
本题解析:
0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液HCL与NaHA反应:NaHA+HCl=NaCl+H2A,所以C中相当于含有0.01mol/LH2A 和0.01mol/LNaHA;0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合NaOH+NaHA=Na2A+H2O 所以D中相当于含有0.01mol/LNa2A,因此,
A、0.01mol/L的H2A溶液B、0.01mol/L的NaHA溶液
C、0.01mol/LH2A 和0.01mol/LNaHA D、0.01mol/LNa2A
(1)因弱酸的一级电离为酸性的主要来源,明显只有A、C具有弱酸;而C中HA-会抑制同浓度弱酸的电离,故较小,只有D为正盐,水解程度最大,c(H+)最小,故答案为:A;D;
(2)因C中电离比A小,留下的就比A大,故c(H2A)最大;D中正盐二级水解生成弱酸最难,故c(H2A)最小,故答案为:C;D;
(3)因正盐留下的A2-浓度必最大;弱酸二级电离成A2-最难,故答案为:D;A.
考点:考查弱电解质的电离平衡、盐类的水解
点评:本题考查了弱电解质的电离平衡、盐类的水解,难度中等。本题的难点是C、D关于混合溶液的离子浓度大小的判断。
本题难度:困难
4、选择题 结构简式为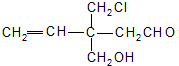
的有机物,不能发生的反应是( )
A.消去反应
B.加成反应
C.酯化反应
D.银镜反应
参考答案:A
本题解析:
本题难度:简单
5、填空题 已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(2)各取5mL上述溶液,分别加热(温度相同),pH较小的是________溶液
(3)H2SO4溶液和NH4Cl溶液中由水电离出的c(H+)之比为__________
(4)取5mL NH4Cl溶液,加水稀释至50mL,c(H+) ____________ 10-6mol·L-1(填“>”、“<”或“=”),
c(NH4+)/c(H+)_______________(填“增大”、“减小”或“不变”)
参考答案:(1) H2SO4
(2) NH4Cl
(3) 10-4:1
(4) > 减小
本题解析:(1)氯化铵溶液的pH=5是因为铵根离子的水解造成的,而加水稀释会促进氯化铵水解正向进行,抑制氢离子浓度的减小,所以pH增大较多是硫酸溶液,则pH较大的是H2SO4;
(2)加热促进氯化铵的水解,溶液中氢离子浓度增大,pH减小,而硫酸中的氢离子浓度不变,所以pH不变,所以pH较小的溶液是NH4Cl溶液;
(3)酸对水的电离起抑制作用,而盐的水解对水的电离起促进作用,硫酸溶液中水电离产生的氢离子浓度等于溶液中的氢氧根离子浓度为1×10-9mol/L,而氯化铵溶液中的水电离产生的氢离子浓度即是溶液中的氢离子浓度为1×10-5mol/L,所以二者由水电离出的c(H+)之比为1×10-9mol/L/1×10-5mol/L=10-4:1
(4)氯化铵稀释时,水解平衡正向移动,所以稀释10倍后溶液的pH增加值小于1,pH<6,则c(H+)>10-6mol·L-1; c(NH4+)/c(H+)=c(NH3?H2O)/K,加水稀释,c(NH3?H2O)减小,所以比值减小。
考点:考查溶液稀释后pH的变化,离子浓度的变化关系的判断
本题难度:一般