时间:2017-09-24 00:43:22
1、选择题 盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
[? ]
A.10 mL 0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.NaHCO3溶液中:c(H+) +c(H2CO3) =c(OH-)
C.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH-
D.中和体积与pH都相同的HC1溶液和CH3COOH溶液所消耗的NaOH物质的量相同
参考答案:A
本题解析:
本题难度:一般
2、填空题 如图3-1所示,在密闭容器里盛有饱和H2S溶液和H2S气体。
(1)饱和H2S溶液中存在的分子有____________,离子有______________________________。
(2)若将容器顶盖由a压到b位置,则H2S溶液中,各离子浓度的变化情况是________离子浓度增大,而________离子浓度减小。
(3)若从c处不断通入过量的SO2气体,溶液中H+浓度将(? )
A.不断增大
B.先减小,后增大到某值
C.不变
D.先增大,后减小到某值
(4)若由c处不断通入N2,则溶液中H+浓度将________。(填“变大”“变小”或“不变”)
图3-1
参考答案:(1)H2S、H2O? H+、HS-、S2-、OH-
(2)H+、HS-、S2-? OH-?(3)B?(4)变小
本题解析:本题若不清楚氢硫酸的电离平衡,或忽略溶液中的H2O将会导致(1)中出错。若不用勒夏特列原理分析溶解平衡、电离平衡,将导致(2)题的分析中思维混乱。
解答本题的关键是要认识到密闭容器中存在如下平衡体系: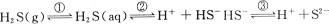
其中平衡①属气体的溶解平衡,②和③属电离平衡。
(1)由上述平衡体系可知,溶液中存在的分子有H2S、H2O;离子有H+、HS-、S2-、OH-。
(2)当顶盖由a压向b时,气体压强增大①向右移动,c〔H2S(aq)〕增大,致使平衡②③均右移。所以浓度增大的离子有H+、HS-、S2-;浓度减小的离子有OH-。
(3)通入SO2气体,SO2与H2S反应生成S和H2O,使H2S(g)浓度减小,平衡①左移,c〔H2S(aq)〕减小,故c(H+)、c(HS-)、c(S2-)均减小,当SO2过量时,SO2和H2O反应生成比氢硫酸酸性更强的H2SO3,故c(H+)再变大,若充入足量的SO2,最后溶液中c(H+)比原来更大。故选B。
(4)若由c处不断通入N2,则顶盖将向上移动,使H2S(g)的浓度减小,平衡①左移,导致c(H+)、c(HS-)、c(S2-)均减小。
本题难度:简单
3、选择题 下列含氧酸中,酸性最弱的是( )
A.HClO
B.HNO2
C.H2SO4
D.HIO4
参考答案:A
本题解析:HNO2为中强酸,而H2SO4、D.HIO4为强酸,只有HClO为弱酸,选A
本题难度:一般
4、选择题 PH=2的两种一元酸x和y,体积均为100ml,稀释过程中PH与溶液体积的关系如图所示,分别滴加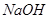 溶液(c=0.1
溶液(c=0.1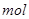 /L)至PH=7,消耗
/L)至PH=7,消耗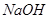 溶液的体积为Vx,Vy,则
溶液的体积为Vx,Vy,则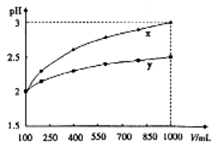
A.x为弱酸Vx<Vy
B.x为强酸Vx>Vy
C.y为强酸Vx>Vy
D.y为弱酸Vx<Vy
参考答案:D
本题解析:酸稀释过程中溶液的PH与稀释的关系为:
若为强酸,加水稀释至原溶液体积的10n倍,PH增加n个单位;
若为弱酸,加水稀释至原溶液体积的10n倍,PH增加的单位数少于n。
注:无论是强酸还是弱酸,无论稀释多少倍溶液PH均小于7。
由图分析,当加水稀释至原溶液体积的10倍时,X酸的PH由2增大为3,即X为一元强酸;而Y酸PH变化少于1介于2、3之间,所以Y酸为一元弱酸。
等体积等PH的一元强酸与一元弱酸,弱酸的物质的量过量,中和NaOH溶液,消耗的NaOH的物质的量更多。
综上所述,正确确答案为D。
本题难度:一般
5、选择题 下列事实可证明一水合氨是弱电解质的是
A.0.1mol/L的氨水可使酚酞试液变红
B.0.1mol/L的氯化铵溶液的pH约为5
C.在相同条件下,氨水溶液的导电性比强碱溶液弱
D.铵盐受热易分解
参考答案:BC
本题解析:A、只能证明氨水先碱性,不能证明电离程度,错误;B、能证明NH4Cl是强酸弱碱盐,也能证明NH3?H2O是弱碱,正确;C、能证明NH3?H2O的电离程度小于强碱,也能证明一水合氨不完全电离,正确;D、只能证明铵盐热稳定性差,不能证明一水合氨是否完全电离,错误。
本题难度:一般