时间:2017-09-24 00:43:01
1、选择题 已知苯酚钠溶液中通入二氧化碳,充分反应后只能生成苯酚和碳酸氢钠;而偏铝酸钠溶液中通入二氧化碳时,可生成氢氧化铝和碳酸钠,则下列说法正确的是
A.酸性:苯酚<氢氧化铝<碳酸
B.结合质子的能力:  <HCO3-<CO32-<AlO2-
<HCO3-<CO32-<AlO2-
C.同温、同浓度下溶液碱性强弱:偏铝酸钠>碳酸钠>苯酚钠>碳酸氢钠
D.相同pH的下列溶液其物质的量浓度:碳酸氢钠>碳酸钠>苯酚钠 >偏铝酸钠
参考答案:C
本题解析:A 错 苯酚是弱酸,氢氧化铝显两性,所以苯酚酸性应大于氢氧化铝
B 错 酸性越强,电离出的酸根结合质子能力越弱,结合质子的能力 >HCO3-
>HCO3-
C 对酸性越弱,此酸电离出的离子形成的盐碱性越强。
D 错PH相同时,碱性越强的物质,它的物质的量浓度越小,碳酸钠的浓度应小于苯酚钠的浓度。
本题难度:一般
2、选择题 下列关于苯酚的叙述中,错误的是
[? ]
A.苯酚在水中的溶解度随温度的升高而增大
B.苯酚易溶于乙醇等有机溶剂
C.苯酚没有毒,其稀溶液可用作防腐剂和消毒剂
D.苯酚水溶液呈弱酸性,能与碱反应
参考答案:C
本题解析:
本题难度:简单
3、实验题 (6分)为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如下图所示装置,一次实验即可达到目的(不必选用其他酸性物质)。
请据此实验回答下列问题:
(1)在烧瓶中装某可溶性正盐溶液,分液漏斗中所盛放的试剂应为?。
(2)装置B中所盛的试剂是?,其作用是?。
(3)装置C中所盛的试剂是?,C中反应的离子方程式是?。
参考答案:(共6分)(1)CH3COOH
(2)饱和NaHCO3溶液、除去CO2中混有的醋酸杂质
(3)苯酚钠溶液?(以上四个空每空1分,共4分);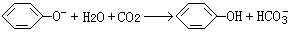 ?(2分)
?(2分)
本题解析:酸性顺序为:CH3COOH>H2CO3>C6H5OH,我们可以根据强酸制弱酸的原理来设计实验。
A漏斗的CH3COOH滴入烧瓶中,与碳酸盐反应产生弱酸H2CO3,分解出的CO2气体中混有的CH3COOH可通过B中的NaHCO3溶液除去,CO2与C中的苯酚钠溶液反应产生苯酚。
本题难度:一般
4、选择题 已知酸性强弱顺序为H2CO3> >HCO3-,下列化学方程式正确的是
>HCO3-,下列化学方程式正确的是
[? ]
A.2 +H2O+CO2→2
+H2O+CO2→2 +Na2CO3
+Na2CO3
B. +H2O+CO2
+H2O+CO2 +NaHCO3
+NaHCO3
C. +Na2CO3→
+Na2CO3→ +NaHCO3
+NaHCO3
D. +NaHCO3→
+NaHCO3→ +H2CO3
+H2CO3
参考答案:BC
本题解析:
本题难度:一般
5、计算题 为测定某工厂排放的污水中苯酚的含量,进行如下实验:取污水试样10.00mL加水稀释至100mL,加入10.0mL一定浓度的KBrO3和KBr的混合溶液,立即加入5mL盐酸,摇匀后加入1gKI固体(足量),再摇匀,放置5min。用0.01000mol/LNa2S2O3标准溶液滴定 91ExAM.org至淡黄色,加入1mL淀粉溶液,继续滴定至蓝色刚好褪去,用去Na2S2O3标准溶液14.46mL。同时以水代替污水试样做对比实验,用去Na2S2O3标准溶液38.46 mL。
⑴已知上述实验中发生的反应有:KBrO3+5KBr+6HCl = 3Br2+3H2O+6KCl
2Na2S2O3+I2 = Na2S4O6+2NaI
请写出实验中还涉及的另两个反应的化学方程式:________________________、________________________。
⑵试计算此污水中苯酚的含量(以mg/L表示,苯酚的相对分子质量为94.00)。
参考答案:⑴ Br2+2KI = 2KBr+I2;
⑵376.0mg/L
本题解析:
本题难度:一般