时间:2017-09-24 00:39:36
1、填空题 (12分)⑴某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应中还原产物是____;若反应过程中转移了0.3moL电子,则氧化产物的质量是__?g。
⑵将a mol Cl2 通入含b mol FeBr2的溶液中,
当0< a / b≤1/2 时,反应的离子方程式为: ?2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,
写出另2个可能发生的离子方程式:
①?当 a / b =1时,_______________________?______;
②?当a / b≥3/2时,________________?_____________。
⑶观察如下反应,总结规律,然后完成下列问题:
①?Al(OH)3 +H2O Al(OH)4- + H+? ②NH3+H2O
Al(OH)4- + H+? ②NH3+H2O NH4+?+ OH_
NH4+?+ OH_
Ⅰ.已知B(OH)3是一元弱酸,试写出其电离方程式________________________?__
Ⅱ.N2H4是二元弱碱,试写出其第二步电离方程式___________?_________________
参考答案: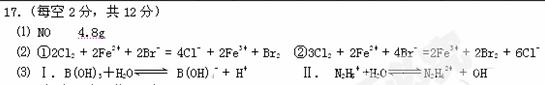
本题解析:略
本题难度:困难
2、计算题 用足量的稀H2SO4溶解FeS和Fe(OH)3的混合物28.3g,可得到1.6g硫,原混合物中FeS的质量可能是多少克
参考答案:FeS+H+=Fe2++H2S
Fe(OH)3+3H+=Fe3++3H2O
2Fe3++H2S=2Fe2++2H++S↓由方程式可算出,要生成1.6g硫,须有m(FeS)=4.4g,m[Fe(OH)3]=10.7g,因4.4+10.7=15.1(g)<28.3(g),说明混合物过量。所以:①当FeS完全反应时,有FeS4.4g;
②当Fe(OH)3完全反应时,有Fe(OH)310.7g,则混合物中FeS的质量为28.3-10.7=17.6(g).
本题解析:列出反应的化学方程式:
FeS+H+=Fe2++H2S
Fe(OH)3+3H+=Fe3++3H2O
2Fe3++H2S=2Fe2++2H++S↓由方程式可算出,要生成1.6g硫,须有m(FeS)=4.4g,m[Fe(OH)3]=10.7g,因4.4+10.7=15.1(g)<28.3(g),说明混合物过量。所以:①当FeS完全反应时,有FeS4.4g;
②当Fe(OH)3完全反应时,有Fe(OH)310.7g,则混合物中FeS的质量为28.3-10.7=17.6(g).
本题难度:简单
3、选择题 农药波尔多液可用于水果灭虫,是由石灰水和硫酸铜溶液混合而成的悬浊液。它不能用铁制容器盛放,是因为铁与该农药中的硫酸铜起反应。在该反应中,对铁的叙述错误的是(?)
A.铁发生还原反应
B.铁发生氧化反应
C.铁是还原剂
D.铁失去电子
参考答案:A
本题解析:略
本题难度:简单
4、选择题 下列有关含铜化合物的说法错误的是(设NA为阿伏加德罗常数的值)
A.用盐酸可以洗去铜表面的铜锈
B.0.1mol/L的CuSO4溶液中,Cu2+的数目一定小于0.1NA
C.在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明Ksp(CuS)远小于Ksp(FeS)
参考答案:B
本题解析:A、铜锈的主要成分是碱式碳酸铜,所以可用盐酸可以洗去铜表面的铜锈,A正确;B、由于不能确定硫酸铜溶液的体积,因此0.1mol/L的CuSO4溶液中,Cu2+的数目不一定小于0.1NA,B不正确;C、铁离子的氧化性强于铜离子,所以在CuCl2和FeCl3的混合溶液中加入铁粉,铁首先与铁离子发生氧化还原反应,然后再与铜离子发生置换反应。因此若有固体残留,则其中一定含有铜,C正确;D、在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明不能生成硫化亚铁。因此根据沉淀容易向更难溶的方向转化可知Ksp(CuS)远小于Ksp(FeS),D正确,答案选B。
本题难度:一般
5、实验题 (16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).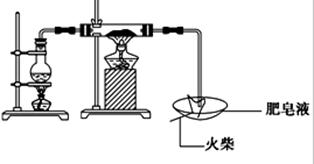
(1)如何检查该装置的气密性:?
(2)写出铁与水蒸气反应的化学方程式?
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| ? | 实验步骤 | 预期现象与结论 |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的?,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | ? |
| 步骤2 | 取少量步骤1中滤液于试管中,? ? | ? ? |
| 步骤3 | 取少量步骤1中滤液于试管中,? ? | ? ? |
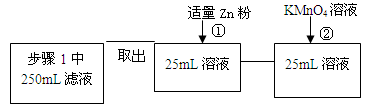
参考答案:
(1)将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱。(2分)
(2)3Fe+4H2O(g)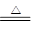 Fe3O4+4H2(2分)
Fe3O4+4H2(2分)
(3)
?
实验步骤
预期现象与结论
步骤1
3mol/L H2SO4(2分)
?
步骤2
滴加1~2滴20%KSCN(2分)
溶液变红色,则固体产物含+3价铁(1分)
步骤3
滴加1~2滴0.01mol/L KMnO4(2分)
溶液紫色褪去,则固体产物含+2价铁(1分)
?
除去反应后固体中可能未反应完的铁粉,以免影响后续实验的结果分析。
(4)将Fe3+还原为Fe2+?(2分)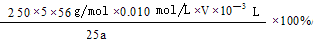 (2分)
(2分)
本题解析:
(1)检查装置的气密性有加热法和液压法,从本装置的情况看,应该选用加热法,注意操作要C处将导管伸入水槽,并微热A处圆底烧瓶,现象是导管末端出现气泡,停止加热后导管末端出现一段水柱,结论是气密性良好,用操作现象结论的思维进程去答题。
(2)书写这个方程式要注意金属和水反应的特点,如常见的Na、Mg、Al、Fe等金属与水的反应。
(3)验证固体产物中铁元素的价态 ,先要将固体溶解,但考虑到可能有铁单质剩余,会和三价铁离子反应,所以要先除去铁单质,选用的试剂是硫酸铜溶液,然然,剩余的固体则应用稀硫酸溶解(因为硝酸的氧化性会氧化二价铁),接着确定检验相应离子的试剂,三价铁离子用的是硫氰化钾溶液,而检验二价铁则从限选试剂中只能用高锰酸钾溶液,利用二价铁离子的还原性,答题时注意试剂的用量和叙述即可。
(4)弄清实验目的“固体产物中铁元素的质量分数的测定”,所以由加入锌粉后溶液的黄色恰好消失,可知是用于还原三价铁离子;由题意可 知,n(Fe2+)=5n(MnO4-) m(Fe)=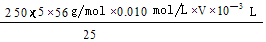 ,再求质量分数即可
,再求质量分数即可
本题难度:一般