时间:2017-09-24 00:38:35
1、选择题 已知反应:O2 + PtF6  O2[PtF6],O2[PtF6]为配位化合物(其中Pt为+5价),对于此反应,下列说法正确的是
O2[PtF6],O2[PtF6]为配位化合物(其中Pt为+5价),对于此反应,下列说法正确的是
A.O2[PtF6]的配位原子是F和O,配位数为8
B.此反应O2是氧化剂,PtF6是还原剂
C.O2[PtF6]中Pt与F之间以离子键相结合
D.每生成1mol O2[PtF6],转移1 mol电子
参考答案:D
本题解析:O2[PtF6]的配位原子是F,配位数为6,Pt与F之间以配位键相结合,选项A、C不正确;Pt为+5价,所以该化合物中氧元素的化合价是+1/2价,所以每生成1mol O2[PtF6],转移1 mol电子,选项D正确;反应O2是还原剂,PtF6是氧化剂,选项B不正确,答案选D。
本题难度:一般
2、填空题 下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| ? | ② | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ③ | ? | ? | ? | ? |
| ? | ④ | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ⑤ | ? | ? | ⑥ | ⑦ | ? |
| ? | ⑧ | ? | ? | ? | ? | ? | ⑨ | ? | ? | ⑩ | ? | ? | ? | ? | ? | ? | ? |
 ?
?
参考答案:(每空1分,共,11分)(1)⑨?(2)苯 (3)Cl> S> Mg> Al(4)2,2
(5)? 1 ,三角锥形,极性?(6) Be(OH)2+2NaOH=Na2BeO2+2H2O?(7)8 , 12
本题解析:(1)区的名称来自于按照构造原理最后填入电子的轨道名称,属于表中属于d区的元素是⑨。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子是苯。
(3)④ ⑤ ⑥ ⑦四种元素分别是Mg、Al、S、Cl。金属性越强第一电离能越大。但由于镁元素的3s轨道电子处于全充满状态,所以第一电离能对于Al元素的,则第一电离能由大到小的顺序是Cl> S> Mg> Al。
(4)按原子轨道的重叠方式,③与⑥形成的化合物是二硫化碳,分子中含有2个双键。而双键是由1个σ键和1个π键构成的,所以分子中σ键有2个,π键有2个。
(5)某元素的特征电子排布式为nsnnpn+1,则该元素是第ⅤA族元素。所以该元素原子的核外最外层电子的孤对电子数为1;该元素与元素①形成的分子X是氨气,其空间构形为三角锥形结构,属于极性分子。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。由于⑤是铝元素,能氢氧化铝能和氢氧化钠溶液反应生成偏铝酸钠和水,则元素②即Be的氢氧化物与NaOH溶液反应的化学方程式Be(OH)2+2NaOH=Na2BeO2+2H2O。
(7)⑨是铁元素,则根据图1可知,与⑨原子等距离且最近的⑨原子数为8个;在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为12个。
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养。该题考查的知识点比较多,且分散,但都很基础,主要是有利于培养学生灵活运用基础知识解决实际问题的能力,有助于培养学生的应试能力和学习效率。
本题难度:困难
3、填空题 请回答下面问题
(1)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表
参考答案:(1)NaF、MgF2为离子晶体,SiF4为分子晶体,所以NaF、MgF2的熔点远比SiF4熔点要高,又因为Mg2+
半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MgF2的熔点大于NaF的熔点。
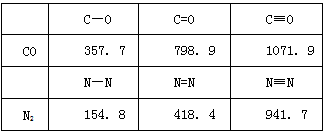
(2)2;打开CO的第一个化学键所需的能量:1071.9-798.9=273kJ/mol,打开N2的第一个化学键所需的能量:941.7-418.4=523.3kJ/mol,前者所需的能量小,故CO更活泼
本题解析:
本题难度:一般
4、选择题 下列叙述正确的是
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
参考答案:B
本题解析:氨气中心原子氮原子是sp3杂化,含有1对孤对电子,是三角锥形,属于极性分子,A不正确。水中心原子氧原子是sp3杂化,含有2对孤对电子,是V形,属于极性分子,B正确。四氯化碳中心原子碳原子是sp3杂化,没有孤对电子,是正四面体型,属于非极性分子,C不正确。CO2中心原子碳原子是sp杂化,是直线型结构,属于非极性分子,D不正确。答案选B。
本题难度:一般
5、选择题 元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中错误的是
[? ]
A.次氯酸的电子式: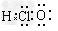 ?
?
B.S2-的结构示意图: ?
?
C.O—18的原子符号: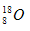 ?
?
D.CO2分子的结构式:O=C=O
参考答案:A
本题解析:
本题难度:简单