时间:2017-09-24 00:37:55
1、选择题 卤族元素随着原子序数的增大,下列递变规律正确的是
A.单质熔、沸点逐渐降低
B.单质的氧化性逐渐增强
C.原子半径逐渐增大
D.气态氢化物稳定性逐渐增强
参考答案:C
本题解析:同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,相应氢化物的稳定性也逐渐减弱,所以选项C正确,BD错误。卤素单质的熔沸点自上而下是逐渐升高的,A是不正确。答案选C。
本题难度:简单
2、选择题 下列说法中,正确的是( )
A.在Na、P、Cl、Ar四种元素中,最高正化合价数值最大的是P
B.在N、F、Mg、Cl四种元素中,原子半径最小的是Mg
C.原子序数从3-10的元素,随着核电荷数的递增,原子的最外层电子数递增
D.SiH4(硅烷)比CH4稳定
参考答案:A.Cl的最外层有7个电子,最高化合价为+7价,而P的最高化合价为+5价,Ar为惰性气体,性质稳定,难以形成化合物,故A错误;
B.N、F原子核外都有2个电子层,且原子半径N>F,Mg、Cl原子核外都有3个电子层,且原子半径Mg>Cl,原子半径最大的是Mg,故B错误;
C.同周期元素从左到右,原子核外最外层电子数逐渐增多,故C正确;
D.非金属性:C>Si,则氢化物稳定性:SiH4(硅烷)<CH4,故D错误.
故选C.
本题解析:
本题难度:简单
3、推断题 已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题。
(1)D元素原子的结构示意图为_______________;
(2)A、B、C三种元素的原子半径由小到大的顺序为_______________(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为?______________;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈________(填“酸”、“碱”或“中”)性;
(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是_______________(用化学方程式表示)。
参考答案:(1)
(2)N<Al<Na
(3)Al2O3+2OH-=2AlO2- +H2O
(4 )酸
(5)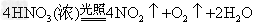
本题解析:
本题难度:一般
4、简答题 下列有关比较中,大小顺序排列错误的是( )
A.热稳定性:PH3>H2S>HBr>NH3
B.物质的熔点:石英>食盐>冰
C.结合H+的能力:CO32->CH3COO->SO42-
D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
参考答案:A.同一周期从左到右,氢化物稳定性逐渐增强,同一主族,从上到下,氢化物的稳定性逐渐减弱,NH3中的氮原子半径小于HBr,所以N-H键能大于H-Br键能,NH3比HBr稳定,而溴的非金属性大于硫,硫大于磷,所以稳定性NH3>HBr>H2S>PH3,故A错误;
B.石英为原子晶体,食盐为离子晶体,冰为分子晶体,故熔点:石英>食盐>冰,故B正确;
C.硫酸是强酸,醋酸酸性强于碳酸,所以对应酸根离子结合H+的能力:CO32->CH3COO->SO42-,故C正确;
D.分散系的粒子直径大小关系,浊液>胶体>溶液,故分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故D正确;
故选A.
本题解析:
本题难度:一般
5、选择题 下列说法中错误的是
[? ]
参考答案:AD
本题解析:
本题难度:简单