时间:2017-09-24 00:28:42
1、简答题 已知:有机化合物A的分子式为C3H2O,能发生银镜反应.
回答下列问题:
(1)写出反应类型:反应①______?反应②______.
(2)写出结构简式:A______?E______.
(3)物质C中共有14个碳原子,写出生成C的化学方程式______.
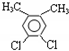
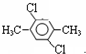
(4)若C8H8Cl2苯环上的一溴取代物只有一种,其可能的结构除了外,还有______和 
(用结构简式表示).
参考答案:有机化合物A的分子式为C3H2O,能发生银镜反应,说明含有醛基,应为CH≡C-CHO,与足量氢气发生加成反应生成B为CH3CH2CH2OH,由对苯二甲酸可知D为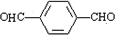
,E为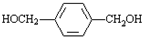
,则C为
,
(1)反应①为CH3CH2CH2OH在浓硫酸作用下的消去反应,反应②为氯代烃的水解反应,也是取代反应,
故答案为:消去;取代;
(2)由以上分析可知A为CH≡C-CHO,E为
,
故答案为:CH≡C-CHO;
;
(3)CH3CH2CH2OH和对苯二甲酸发生酯化反应,生成C的化学方程式为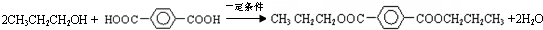
,
故答案为: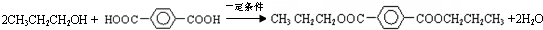
;
(4)若C8H8Cl2苯环上的一溴取代物只有一种,说明苯环上只有一种H原子,结构应对称,可能的结构有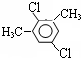
、
、
,
故答案为:
;
;
(任写2种).
本题解析:
本题难度:一般
2、选择题 下列反应既不是水解反应,又不是氧化还原反应的是
[? ]
A.NH4++H2O NH3·H2O+H+
NH3·H2O+H+
B.HS-+H2O H2S+OH-
H2S+OH-
C.Br2+H2O HBr+HBrO
HBr+HBrO
D.H2S+H2O H3O++HS-
H3O++HS-
参考答案:D
本题解析:
本题难度:简单
3、选择题 物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
A.NH4Cl
B.NH4HSO4
C.CH3COONH4
D.NH4HCO3
参考答案:B
本题解析:四个选项中,均存在铵根的水解平衡;
B中NH4HSO4电离出的H+抑制铵根的水解平衡,使NH4+浓度增大;
C中CH3COO-的水解平衡促进铵根的水解平衡,使NH4+浓度减小;
D中HCO3-的水解平衡促进铵根的水解平衡,使NH4+浓度减小;
本题难度:一般
4、选择题 0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是
A.c(K+) + c(H+) = c(S2—) + c(HS—) + c(OH—)
B.c(K+) + c(S2—) = 0.3mol/L
C.c(K+) = c(S2—) + c(HS—) + c(H2S)
D.c(OH—) = c(H+) + c(HS—) + 2c(H2S)
参考答案:D
本题解析:A 错误,电荷守恒,c(S2—) 应为2c(S2—)
B 错误,S2-水解,c(K+) + c(S2—) <0.3mol/L
C 错误,c(K+) = 2c(S2—) +2 c(HS—) +2 c(H2S)
D 正确,遵循质子守恒。
本题难度:一般
5、填空题 (4分) 0.1mol/L的下列溶液, pH由小到大排列顺序为 (填编号);实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是混浊的溶液,产生混浊的原因是(用离子方程式表示): 。
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl 。
参考答案: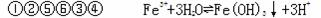
本题解析:略
本题难度:一般