时间:2017-09-24 00:20:57
1、实验题 为确定HCl、H2CO3、H2SiO3的酸性强弱,某同学设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答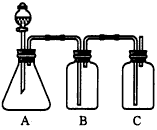
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为_______________。
(2)装置B所盛的试剂是___________,其作用是________________。
(3)装置C所盛试剂是____________,C中反应的离子方程式是___________________。
参考答案:(1)盐酸
(2)饱和NaHCO3溶液;除去挥发出的HCl气体
(3)Na2SiO3溶液;SiO32-+CO2+H2O=H2SiO3(胶体)+CO32-
本题解析:
本题难度:一般
2、填空题 (15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。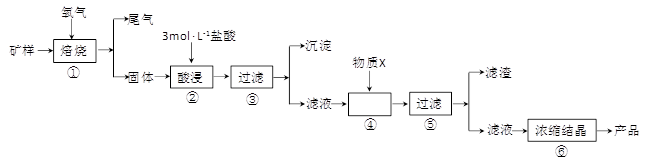
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
参考答案:(1)2H2O2 ="==" 2H2O + O2 ↑,2Na2O2 + 2H2O ="==" 4NaOH + O2 ↑。
(2)2H2SO3+O2=2H2SO4,2(NH4)2SO3+O2=2(NH4)2SO4,2NH4HSO3+O2=2NH4HSO4?
(3)100 mL容量瓶、量筒。
(4)调控溶液的pH,使Fe3+以Fe(OH)3沉淀的形式析出,D。
(5)1×10-15。
本题解析:(1)根据装置图可知是固液不加热制气体,所以用H2O2和Na2O2来制取O2反应方程式为:2H2O2 ="==" 2H2O + O2 ↑,2Na2O2 + 2H2O ="==" 4NaOH + O2 ↑。(2)尾气中含有的是SO2,SO2没有强氧化性不能与NH3反生氧化还原反应,SO2有较强的还原性,可以被空气中的O2所氧化,所以可能发生的氧化还原反应为2H2SO3+O2=2H2SO4,2(NH4)2SO3+O2=2(NH4)2SO4,2NH4HSO3+O2=2NH4HSO4(3)配制3mol · L-1的盐酸100 mL除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有100 mL容量瓶、量筒。(4)根据氢氧化物开始沉淀和完全沉淀的pH可知,只要调节pH值,就可以Fe3+以Fe(OH)3沉淀的形式析出,达到除杂的目的。为了不引入新杂质,还能调节pH值,所以选铜的难溶物,如CuO、Cu(OH)2、CuCO3等。(5)Fe(OH)2完全沉淀的pH是9.0,所以Ksp[Fe(OH)2]=c(Fe2+)·c2(OH-)=1×10-5×(1×10-5)2=1×10-15。
点评:本题属于实验与理论的结合,难度适中,高考中的热门题。
本题难度:一般
3、实验题 已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验,探究该混合金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1 mol/L硫酸、2 mol/L硝酸、2 mol/LNaOH溶液、 20%KSCN溶液。
完成以下实验探究过程:
(1)提出假设
假设1该混合金属粉末中除铝外还含有____________元素。
假设2该混合金属粉末中除铝外还含有_______________元素。
假设3该混合金属粉末中除铝外还含有Fe、Cu元素。
设计实验方案
基于假设3,设计出实验方案。
(2)实验过程
根据上述的实验方案,叙述实验操作、预期现象和结论。 
参考答案:(1)Cu,Fe(2)
本题解析:
本题难度:一般
4、实验题 实验室利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4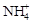 ?+ 6HCHO = 3H++ 6H2O + (CH2)6N4H+
?+ 6HCHO = 3H++ 6H2O + (CH2)6N4H+
然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行如下实验:
[滴定时,1 mol (CH2)6N4H+与1 mol H+相当]
步骤Ⅰ:称取样品1.500 g
步骤Ⅱ:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次
步骤Ⅳ:实验数据记录
<若NaOH标准溶液的浓度为0.1010 mol/L>
| 滴定次数 | 待测液的体积(mL) | 标准溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
参考答案:(1)锥形瓶内溶液颜色的变化(2)最后一滴标准液加入时锥形瓶内溶液颜色变浅红色且半分钟不变化(3)无影响(4)?偏大?(5)?锥形瓶、250 mL容量瓶?
(6) 18.85%
本题解析:本题考查了中和滴定实验的原理以及操作步骤
(1)滴定操作时,眼睛应观察锥形瓶内溶液颜色的变化
(2)滴定终点的判断方法是最后一滴标准液加入时锥形瓶内溶液颜色变浅红色且半分钟不变化
(3)锥形瓶用蒸馏水洗涤后,虽然水未倒尽,但待测液中的H+的物质的量不变,
(4) 碱式滴定管用蒸馏水洗涤后需要再用NaOH溶液润洗,否则相当于NaOH溶液被稀释,滴定消耗的体积会偏高,测得样品中氮的质量分数也将偏大
(5)配制样品溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、滴定管外,还有锥形瓶、250 mL容量瓶
(6)标准溶液的体积应取三次实验的平均值,带入公式即可解得18.85%
本题难度:一般
5、填空题 碘是人体必需的微量元素之一,有“智力元素”之称.食用加碘食盐可预防碘缺乏病.查阅资料知:①在酸性条件下,I-能被NO3-离子氧化成IO3-离子,被H2O2或O2等氧化成I2;②IO3-离子能被HSO3-离子还原成I2.
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3-中的哪一种.
限选试剂如下:1.0mol?L-1HNO3溶液、1.0mol?L-1?H2SO4溶液、1.0mol?L-1NaHSO3溶液、3%?H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;?假设2:该食盐样品中含I-
假设3:______.
Ⅱ.设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表
| 实验步骤 | 预期现象与结论 步骤1:取少量 上述溶液注入试管中,滴入几滴淀粉溶液振荡. 若溶液显______,则假设1成立;否则,假设1不成立,再进行步骤2 步骤2:______ ______ ______ 若溶液显蓝色,则假设2成立,反应的离子方程式为______;否则,假设2不成立,再进行步骤3 步骤3:______ ______ ______ ______ ______ |
参考答案:Ⅰ根据实验目的确定知,另一种实验假设为假设食盐中含有IO3-,故答案为:假设食盐中含有IO3-;
Ⅱ食盐样品中所加碘的存在形式是I2、I-、IO3-中的一种,
步骤1 先用淀粉溶液检验食盐样品中是否有碘单质,如果有碘单质,向食盐样品溶液中加入淀粉溶液,溶液会变蓝色,则假设1成立;否则,假设1不成立;
步骤2? 假设样品溶液中含有碘离子,因为碘离子有还原性,向溶液中加入稀硫酸和几滴双氧水,双氧水有氧化性能把碘离子氧化生成碘单质,再用淀粉溶液检验是否含有碘,若溶液显蓝色,则假设2成立,否则,假设2不成立;
步骤3 假设样品溶液中含有碘酸根离子,因为碘酸根离子有氧化性,向溶液中加入亚硫酸氢钠,亚硫酸氢钠有还原性,能把碘酸根离子还原成碘单质,再用淀粉溶液检验是否含有碘,若溶液显蓝色,则假设3成立,否则,假设3不成立;
故答案为:步骤1:蓝色;
步骤2:取少量上述溶液注入试管中,滴入几滴1.0mol?L-1H2SO4溶液和几滴3%H2O2溶液,再滴入几滴淀粉溶液,振荡;2I-+H2O2+2H+=I2+2H2O;
步骤3:取少量上述溶液注入试管中,滴入几滴1.0mol?L-1NaHSO3溶液,再滴入几滴淀粉溶液,振荡;若溶液呈蓝色,则假设3成立,否则,假设3不成立;
III 碘酸钾较稳定,在空气中不易被还原,碘化钾不稳定,在空气中易失去电子被氧气氧化生成碘单质,碘易升华,所以如果食盐中加入碘化钾,易失效,所以食盐中加碘酸钾,
故答案为:KIO3;碘化钾易被空气中氧气氧化生成碘.
本题解析:
本题难度:一般