时间:2017-09-24 00:10:05
1、选择题 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是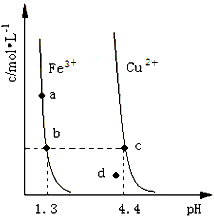
[? ]
A. 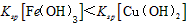
B. 加适量NH4Cl固体可使溶液由点变到点
C. 两点代表的溶液中与乘积相等
D. Fe(OH)3、Cu(OH)2分别在、两点代表的溶液中达到饱和
参考答案:B
本题解析:
本题难度:一般
2、填空题 孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。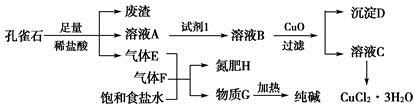
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物 开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物 完全沉淀 | 3.2 | 9.0 | 6.7 | |
 Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。 参考答案:(1)Cl2或H2O2
(2)3.2≤pH<4.7
(3)F——NH3
(4)蒸发浓缩 冷却结晶
(5)5×10-9
本题解析:(1)Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀。所以欲除去Cu2+中混有的Fe2+时,必须先将其氧化为Fe3+。为避免引入新杂质,试剂1可以是氯气或H2O2。
(2)调节pH的原则是使Fe3+完全沉淀而Cu2+不沉淀。
(3)CO2在饱和食盐水中的溶解度小,因此必须先通入NH3。
(5)Cu2++2H2O Cu(OH)2+2H+的平衡常数
Cu(OH)2+2H+的平衡常数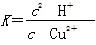 。根据Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)及常温下Kw=c(H+)·c(OH-)得:
。根据Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)及常温下Kw=c(H+)·c(OH-)得: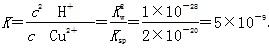
本题难度:困难
3、填空题 最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式____________________________;下列措施中能使n(CH3OH)/n(CO2)增大的是
___________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1mol CO2和3mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。 已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O
则阴极反应为:____________________。
(3)常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)_________c(CO32-) (填“>”、“=”或“<”),原因是________________________(用离子方程式和必要的文字说明)。
(4)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为
4.96×10-9、2.58×10-9。应该选用的试剂是_____________________。
参考答案:(1)CO2(g)+3H2(g) =CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol; CD?
(2)2CO2+4e-+2H2O=2CO+4OH-
(3)>;因为既存在HCO3- CO32-+H+也存在HCO3-+H2O
CO32-+H+也存在HCO3-+H2O H2CO3+OH-而HCO3-的水解程度大于电离程度
H2CO3+OH-而HCO3-的水解程度大于电离程度
(4)Ba(OH)2(或NaOH溶液和BaCl2溶液)
本题解析:
本题难度:困难
4、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图。下列说法正确的是 ( )
A.在任何溶液中,c(Ca2+)、c(SO42—)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42—)一定等于3×10-3mol·L-1
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
参考答案:C
本题解析:A项只有在CaSO4溶液中c(Ca2+)、c(SO42—)才相等;B项b点Qc>Ksp,故有沉淀生成,开始时,c(Ca2+)、c(SO42—)不相等,而反应消耗的Ca2+、SO42—相等,因此平衡后的两种离子的浓度不会都等于3×10-3mol·L-1,B项错误;在平衡线上的点对应的Ksp均相等,C项正确;D项d点溶液通过蒸发后各离子浓度都增大,不可能保持SO42—浓度不变而到达c点,D项错误。
本题难度:一般
5、选择题 下列有关说法正确的是
A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0
C.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀
D.加热0.1 mol·L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强
参考答案:BD
本题解析:A、虽然合金在潮湿的空气中易形成原电池,但并不是所有合金耐腐蚀性都较差,如不锈钢具有较强的抗腐蚀性,错误;B、MgO(s)+C(s)=Mg(s)+CO(g)为气体物质的量增大的熵增加反应,常温下,该反应不能自发进行,则其△H>0,正确;C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,不一定先产生淡黄色沉淀溴化银,还与氯离子和溴离子浓度有关,错误; D、铝离子水解吸热,加热0.1 mol·L-1Al2(SO4)3溶液,铝离子的水解平衡正向移动,水解程度增大、溶液的酸性增强,正确。
考点:考查金属的腐蚀,化学反应方向,沉淀溶解平衡和盐类的水解。
本题难度:一般