时间:2017-09-24 00:03:01
1、选择题 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是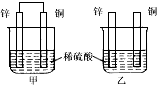
[? ]
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
参考答案:C
本题解析:
本题难度:一般
2、选择题 关于如图所示装置的叙述,正确的是( )
A.铜为负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原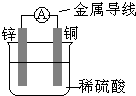
参考答案:由图可知,为Cu、Zn原电池,发生Zn+H2SO4═ZnSO4+H2↑,
A.Cu为正极,表面有气泡产生,故A错误;
B.Cu的质量不变,故B错误;
C.Cu为正极,则电流从铜片经导线流向锌片,故C错误;
D.该反应生成氢气,是因氢离子在铜片表面被还原,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 下列图示中关于铜电极的连接错误的是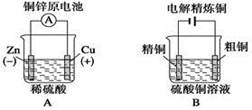 ?
?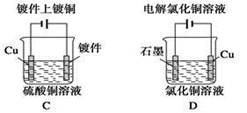
参考答案:C
本题解析:镀件上镀铜时,铜应作阳极,与电源正极相连,镀件作阴极,与电源负极相连。答案选C。
本题难度:一般
4、填空题 (15分)
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/tool
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=一1135.7kJ/mol
则肼完全燃烧的热化学方程式为?。
(2)肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,正极的电极反应式是?,电池工作一段时间后,电解质溶液的pH将?(填“增大”、“减小”、“不变”)。 ?(3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
?(3)右图是一个电化学装置示意图。用肼——空气燃料电池做此装置的电源。
①如果A为含有锌、银、金三种杂质的粗铜,B为纯铜,C为CuSO4。该装置的实际意义是?。
②如果A是铂电极,B是石墨电极,C是AgNO3溶液,若B极增重10.8g,该燃料电池理论上消耗?molN2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因?。
(5)常温下将0.2mol/L HCl溶液与0.2mol/L N2H4·H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)?0.1mol/LHCl溶液中由水电离出的c(H+)(填“大于”、“小于”、或“等于”)。
(6)已知:在相同条件下N2H4·H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4·H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H-5、Cl-、OH-、H+离子浓度南大到小的顺序为?。
参考答案:(1)N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=—534kJ/mol
(2)O2+2H2O+4e-=4OH-?减小(1分)
(3)①精炼粗铜?②0.025mol
(4)N2H4+H2O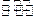 N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O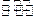 N2H+6+OH-
N2H+6+OH-
(5)大于
(6)c(N2H+5)>c(Cl-)>c(OH-)>c(H+)
本题解析:略
本题难度:简单
5、选择题 甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路,质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2 2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+?④1 mol CH3OH完全反应转移12 mol电子?⑤正极反应:O2+4e-+2H2O==4OH-⑥该电池的电解质溶液可能是碱液。其中正确的是
2CO2+4H2O。下列关于该电池的分析:①甲醇是负极②H+向负极移动③负极反应:CH3OH-6e-+H2O=CO2+6H+?④1 mol CH3OH完全反应转移12 mol电子?⑤正极反应:O2+4e-+2H2O==4OH-⑥该电池的电解质溶液可能是碱液。其中正确的是
A.①②⑥
B.②③④⑤
C.③
D.①③
参考答案:D
本题解析:根据电池反应方程式判断,甲醇发生氧化反应,所以甲醇是负极;负极反应是CH3OH-6e-+H2O=CO2+6H+?;则1 mol CH3OH完全反应转移6 mol电子;氧气是正极,因为甲醇在催化剂作用下提供质子(H+)和电子,所以正极产物不可能是OH-,正极反应是:O2+4e-+4H+==2H2O;电解质溶液不可能是碱液,而使酸液;原电池中的阳离子移向正极,所以正确答案选D。
本题难度:简单