时间:2017-09-24 00:03:01
1、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应为( )
A.2H++2e—→H2↑
B.Fe2++2e—→Fe
C.2H2O+O2+4e—→4OH—
D.Fe3++e—→Fe2+
参考答案:C
本题解析:钢铁发生吸氧腐蚀时,正极上发生的电极反应是2H2O+O2+4e—→4OH— ,B项是负极的电极反应,故答案选C。
考点:原电池
点评:考查原电池原理,属于基础题,解题的关键是要区分正负极发生的电极反应。
本题难度:简单
2、填空题 如下图由浓硫酸、Cu、Al组成一个原电池,试写出正、负极电极反应式,并指出反应类型。
负极:_______________;____________;
正极:_______________;____________。 
参考答案:Cu- 2e- =Cu2+ ;?氧化反应
2H2SO4+2e-=SO42- +SO2↑+ 2H2O ;还原反应
本题解析:
本题难度:一般
3、选择题 一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
[? ]
参考答案:C
本题解析:
本题难度:一般
4、填空题 (20分)(1)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Fe +H2SO4 = FeSO4 + H2 ↑;根据两反应本质,判断能否设计成原电池A B (填“能”或“不能”)
(2)根据下图填空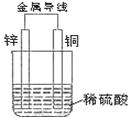
①负极为 ,该电极的方程式为
②正极的现象是 ,发生 反应(填写“氧化”或“还原”)
③电子从 经导线流向 ,溶液中H+向 移动(填具体电极材料)。
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
参考答案:(1)不能 能 (2)① Zn Zn—2e—===Zn2+
② 有气泡产生 还原
③ Zn Cu Cu ④ 1.12L
本题解析:(1)在原电池中有电子的转移,所以只有氧化还原反应才能设计成原电池,A是中和反应,不能设计成原电池,B是氧化还原反应,可以设计成原电池。
(2)在原电池较活泼的金属作负极,锌比铜活泼,锌是负极,失去发生氧化反应,所失去的电子经导线传递到正极上。铜是正极,溶液中的氢离子向正极移动,在正极上得到电子,发生还原反应生成氢气,电极反应式为2H++2e—===H2↑。若转移0.1mol电子,则生成氢气0.05mol,其体积是0.05mol×22.4L/mol=1.12L。
本题难度:一般
5、选择题 下图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是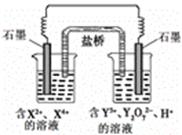
A.左池电极反应式:X4+ + 2e-=X2+
B.每消耗1mol Y2O72-,转移3mol电子
C.改变右池溶液的c(H+),电流强度不变
D.左池中阴离子数目增加
参考答案:D
本题解析:由题意右池中Y2O72-转化为Y3+化合价降低说明右池是正极,左池是负极。在原电池中阳离向正极移动,阴离子向负极移动。所以D选项是正确的。
本题难度:一般