时间:2017-09-24 00:00:39
1、选择题 向0.2L 0.1mol/LNaOH溶液中通入448mL(标准状况)H2S气体,已知NaHS溶液显碱性,则所得溶液中离子浓度关系正确的是
[? ]
A.c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
B.c(Na+) =c(H2S)+c(HS-)+c(S2-)+c(OH-)
C.c(Na+)>c(HS-)>c(OH-)>c(H2S)>c(S2-)>c(H+)
D.c(S2-)+c(OH-)=c(H+)+c(H2S)
参考答案:D
本题解析:
本题难度:一般
2、选择题 有四种混合溶液,分别由等体积0.1mol·L-1的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与
NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3。下列关于该四种混合溶液的各项排序正确的是
[? ]
A.pH:②>③>④>①
B.c(CH3COO-):②>④>③>①
C.c(H+):①>③>②>④
D.c(CH3COOH):①>④>③>②
参考答案:B
本题解析:
本题难度:一般
3、选择题 现有等浓度的下列溶液:(1)NaHSO4 (2)NH4Cl (3)CH3COONa (4)NaCl (5)NaOH (6)Ba(OH)2 (7)H2SO4 按溶液pH由小到大排列
[? ]
A.(1)(2)(4)(5)(3)(7)(6)
B.(7)(1)(2)(4)(3)(5)(6)
C.(6)(5)(3)(4)(2)(1)(7)
D.(7)(1)(3)(4)(2)(5)(6)
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列溶液中微粒的物质的量浓度关系正确的是( )
A.室温下,向0.1?mol?L-1NH4HSO4溶液中滴加等物质的量溶质的NaOH溶液:[Na+]=[SO
参考答案:A、等物质的量的NH4HSO4和NaOH恰好反应生成硫酸钠、硫酸铵,且硫酸钠和硫酸铵的物质的量相等,溶液中C(Na+)=C(SO?2-4),铵根离子能水解导致:C(Na+)>C(NH?+4);铵根离子能水解导致溶液呈酸性,溶液中C(H+)>C(OH-),故A错误.
B、碳酸氢钠溶液中,碳酸氢根离子能水解导致溶液呈碱性,C(H+)<C(OH-);在溶液中,碳酸氢根离子能水解但比较微弱,主要还是以碳酸氢根离子为主,所以溶液中C(HCO3-)>C(OH-),故B错误.
C、溶液中遵循质子守恒,溶液中氢氧根离子浓度等于含有氢元素的微粒浓度之和,即C(OH-)=C(H+)+C(HCO?-3)+2C(H2CO3),所以C(OH-)-C(H+)=C(HCO?-3)+2C(H2CO3),故C正确.
D、pH=4.75,浓度均为0.1?mol?L-1的CH3COOH、CH3COONa混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度导致溶液呈酸性,根据电荷守恒得:C(CH3COO-)+C(OH-)=C(Na+)+C(H+),醋酸是弱酸,在溶液中只有部分电离,所以钠离子浓度大于醋酸浓度,所以C(CH3COO-)+C(OH-)>C(CH3COOH)+C(H+),故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 25℃时,在25 mL0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是 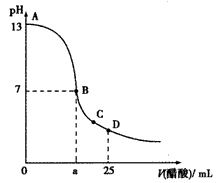
[? ]
A.B点的横坐标a=12.5
B.C点时溶液中有: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有: c( CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
参考答案:C
本题解析:
本题难度:一般