时间:2017-09-24 00:00:39
1、选择题 某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1
③pH相等的四种溶液:a.CH3COONa;b.C6H5ONa c.NaHCO3 d.NaOH,其溶质物质的量浓度由小到大顺序为:d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka?Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是?
[? ]
A.全部?
B.③⑤⑥?
C.④⑤⑥?
D.①②④
2、选择题 室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
[? ]
A.若PH>7,则一定是C1V1=C2V2
B.在任何情况下都是C(Na+)+C(H+)=C(CH3COO-) +C(OH-)
C.当PH=7时,若V1=V2,一定是C2>C1
D.若V1=V2,C1=C2,则C(CH3COO-) +C(CH3COOH)=C(Na+)
3、填空题 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)?②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)?④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是______,上述四种离子浓度的大小顺序为(填序号)______;
(2)若四种离子的关系符合③,则溶质为______;
若四种离子的关系符合④,则溶质为______;
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图1正确的是(填图象符号)______;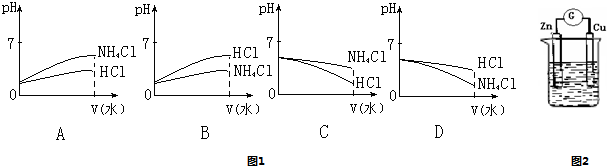
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)______c(NH3?H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)______c(OH-).
(5)如图2所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是______,正极反应式是______.
4、选择题 室温下0. 1mol/L的NH4CN溶液的pH等于9.32,据此,在室温下,下列说法错误的是
[? ]
A.上述溶液能使甲基橙试剂变黄色
B.室温下,NH3·H2O是比HCN更弱的电解质
C.上述溶液中CN-的水解程度大于NH4+的水解程度
D.室温下,0.1mol/L NaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度
5、选择题 温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤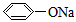 、
、
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是
[? ]
A. ③①④②⑥⑤
B. ①③⑥④②⑤
C. ③②①⑥④⑤
D. ⑤⑥②④①③