时间:2017-09-23 23:59:38
1、填空题 随着世界粮食需求量的增加,农业对化学肥料的需求越来越大。氮肥是需求最大的一种化肥。氮肥的生产和合理施用在农业生产中起着重大作用。合成氨及化肥生产流程示意图如下: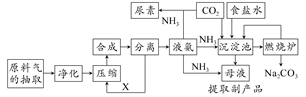
(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在________中进行合成氨。则沿X方向回去的物质是________。
(2)目前生产尿素是以氨气与CO2为原料,发生反应的化学方程式是________、________。
尿素适用于各种土壤,在土壤中尿素发生水解,其水解的化学方程式是________。
(3)沉淀池中发生反应的化学方程式是________________。
(4)上述生产中的副产品氯化铵长期使用会造成土壤酸化、变硬甚至板结。对土壤的酸碱性进行测定与改良是保护________、提高土壤肥力的有效途径。测定土壤的pH的方法是________。
参考答案:(1)合成塔;H2、N2
(2)2NH3+CO2 NH2COONH4;NH2COONH4
NH2COONH4;NH2COONH4 CO(NH2)2+H2O;CO(NH2)2+H2O=2NH3↑+CO2↑
CO(NH2)2+H2O;CO(NH2)2+H2O=2NH3↑+CO2↑
(3)NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓
(4)土壤资源;取土样于试管中,加5 mL蒸馏水振荡,静置后,取上层清液,用精密pH试纸或pH计测上层清液的pH
本题解析:(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450°C左右用氮、氢混合气体在合成塔中进行合成氨,沿X方向回去的物质是H2、N2,以循环利用。(2)目前,生产尿素是以氨气与CO2为原料,发生反应的化学方程式是2NH3+CO2 NH2COONH4、NH2COONH4
NH2COONH4、NH2COONH4 CO(NH2)2+H2O。在土壤中尿素发生水解,其水解的化学方程式是CO(NH2)2+H2O=2NH3↑+CO2↑。(3)沉淀池中发生反应的化学方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓。(4)对土壤的酸碱性进行测定与改良是保护土壤资源、提高土壤肥力的有效途径。测定土壤的pH的方法是:取土样于试管中,加5 mL蒸馏水振荡,静置后,取上层清液,用精密pH试纸或pH计测上层清液的pH。
CO(NH2)2+H2O。在土壤中尿素发生水解,其水解的化学方程式是CO(NH2)2+H2O=2NH3↑+CO2↑。(3)沉淀池中发生反应的化学方程式是NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓。(4)对土壤的酸碱性进行测定与改良是保护土壤资源、提高土壤肥力的有效途径。测定土壤的pH的方法是:取土样于试管中,加5 mL蒸馏水振荡,静置后,取上层清液,用精密pH试纸或pH计测上层清液的pH。
本题难度:一般
2、填空题 电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+Fe3+和Al3+等,且酸性较强。为回收利用铬元索,此工业废水通常采用如下流程处理: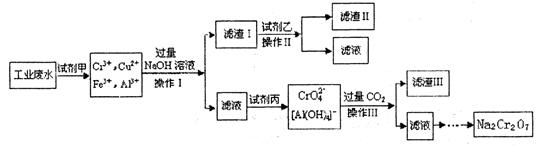
已知: (1)?铬元素有以下循环过程: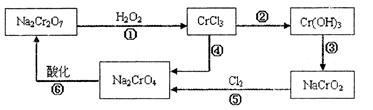
(2)?Cu(OH)2能溶于氨水: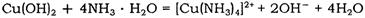
请回答下列问题:
(1)?加入试剂甲的目的:________________
(2)?试剂乙的名称:________? ,试剂丙的化学式:________________
(3)?上述操作I、II、III相同,则进行该实验操作所需要的主要玻璃仪器有________________
(4)?滤渣I的主要成分为________________(写化学式)。
(5)?在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:______________
(6)?铬元素循环过程的反应⑥的离子方程式:_____________________________;
废水处理流程中生成滤渣III的离子方程式:_______________________
参考答案:(14分)(1)将Fe2+氧化成Fe3+(1分)(2)氨水(1分)? Cl2(1分)
(3)烧杯、漏斗、玻璃棒(3分)(4)Cu(OH)2、Fe(OH)3(2分)
(5) 8/3×6.02×1023(2分)
(6)2CrO42- + 2H+ = Cr2O72- + H2O(2分)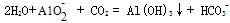 ?(2分)
?(2分)
本题解析:略
本题难度:一般
3、选择题 按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,即原子利用率为100%.以下反应不符合这种理念的是( ? )
A.制环氧乙烷:2CH2=CH2+O2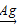
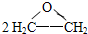
B.制甲基丙烯酸甲酯:CH3C≡CH+CO+CH3OH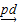 CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
C.制丙烯腈:2CH3-CH=CH2+2NH3+3O2→2CH2=CH-CN+6H2O
D.制聚氯乙烯:n?CH2=CHCl 「CH2-CHCl」n
「CH2-CHCl」n
参考答案:C
本题解析:
本题难度:一般
4、填空题 (14分)青铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)?冶炼铜的反应为
8CuFeS2 + 21O2 8Cu + 4FeO + 2Fe2O3 + 16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是_________(填元素符号)。
(2)?上述冶炼过程产生大量SO2,下列处理方案中合理的是__________(填代号)。
a.?高空排放? b.用于制备硫酸
c.?用纯碱溶液吸收制Na2SO4? d.用浓硫酸吸收
(3)?过二硫酸钾(K2S2O8)具有强氧化性,可将I?氧化为I2:S2O82? + 2I? → 2SO42? + I2;通过改变反应途径,Fe3+、Fe2+均可催化上述反应,试用离子方程式表示Fe3+对上述反应催化的过程:__________、__________。
(4)?利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.?除去Al3+ 的离子方程式是____________________________;
b.?选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸?稀硫酸? KSCN溶液? KMnO4溶液? NaOH溶液?碘水
所选试剂为__________,证明炉渣中含有FeO的实验现象为____________________。
参考答案:(1)? Cu、O? 2分? (2)? b、c? 2分
(3)?①2Fe3+ + 2I? → I2 + 2Fe2+?2分?②2Fe2+ + S2O82? → 2Fe3+ + 2SO42?2分
(4) a.? Al3+ + 4OH? → AlO2? + 2H2O?2分
b.?稀硫酸、KMnO4溶液?2分
用稀硫酸浸取炉渣,所得溶液与酸性KMnO4溶液反应,若溶液褪色则证明存在?2分
本题解析:(1)根据方程式可知,氧气是氧化剂,得到电子,因此被还原的元素是氧元素。CuFeS2中铜元素的化合价是+2价,而生成物中有单质铜生成,所以被还原的元素还有铜。
(2)SO2是一种酸性氧化物,能用于制备硫酸,b正确。SO2还是一种大气污染物,不能随意丢弃,a不正确,c正确。浓硫酸不能稀释SO2,d不正确,答案选bc。
(3)铁离子能把碘离子氧化生成单质碘,而在一定条件下,而S2O82?又能把亚铁离子氧化生成铁离子,方程式为2Fe3+ + 2I? → I2 + 2Fe2+、2Fe2+ + S2O82? → 2Fe3+ + 2SO42?。
(4)①由于氢氧化铝是两性氢氧化物,能溶于氢氧化钠中,所以方程式为Al3+ + 4OH?= AlO2? + 2H2O。
②因为氧化亚铁具有还原性,而酸性高锰酸钾溶液又具有氧化性,亚铁离子能使酸性高锰酸钾溶液褪色,据此可以检验,所以选择的试剂是稀硫酸、KMnO4溶液。实验现象是用稀硫酸浸取炉渣,所得溶液与酸性KMnO4溶液反应,若溶液褪色则证明存在。
本题难度:一般
5、填空题 (15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
⑴硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式:?,?
②请说出这种尾气处理方法的优点(说出两点即可)?
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰?kg。
⑵近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO?2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是?。
⑶某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。?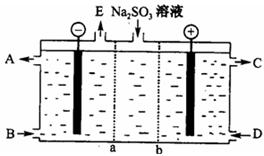
①图中a表示?离子交换膜(填“阴”或“阳”)。A—E分别代表生产中的原料或产品,其中C为硫酸,则A表示?,E表示?。
②阳极的电极反应式为?。
参考答案:(1)①SO2+Ca(OH)2=CaSO3↓+H2O(2分)
CaSO3+H2SO4=CaSO4+SO2↑+H2O(2分)
②原料生石灰、硫酸价格便宜且容易获得;可得到石膏副产品;产生的SO2含量较高可返回作为原料(2分)
③50(2分)
(2)Na2SO3可循环使用;(2分)
(3)①阳,A表示NaOH溶液,E是氢气(3分)
②SO2-3—2e+H2O=2H++SO2-4(2分)
本题解析:略
本题难度:一般