时间:2017-09-23 23:47:36
1、填空题 如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式〔当电解质溶液为NaOH(aq)或KOH(aq)时〕两种。试回答下列问题: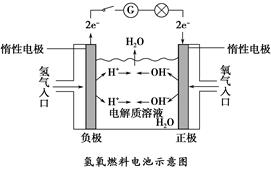
(1)酸式电池的电极反应:负极_______________,正极______________;电池总反应:________________;
电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
(2)碱式电池的电极反应:负极_________________,正极_________________;电池总反应:______________;电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
2、选择题 一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
A.正极上发生的反应是:O2+4e-+2H2O=4OH-
B.该电池反应的化学方程式为:CH3CH2OH+3O2点燃2CO2+3H2O
C.检测时,电解质溶液中的H+向正极移动
D.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
3、选择题 下列关于电解的说法中,正确的是( )
A.电解池是把化学能转变为电能的装置
B.电解精炼铜时,粗铜板做阴极
C.电镀时,通常把待镀的金属制品做阴极
D.工业电解饱和食盐水用于生产金属钠和氯气
4、选择题 乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为:C2H5OH+3O2=2CO2+3H2O下列说法错误的是( )
A.电池工作时,质子向电池的正极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a为负极,电极反应式是C2H5OH+3H2O+12e-=2CO2+12H+
D.b为正极,电极反应式是4H++O2+4e-=2H2O
5、填空题 (14分)碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)用CO2 和H2 合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机。已知: +
+
 =
=  ?+ 2
?+ 2 △H = -725.5 kJ·mol-1
△H = -725.5 kJ·mol-1
2H2 (g)+O2(g) = 2H2O(l)?△H = -565.6 kJ·mol-1,
请写出工业上用CO2 和H2 合成CH3OH(l)的热化学方程式:?;
(2)一种新型燃料电池,一极通入空气,一极通入CH3OH(g),电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。则在该熔融电解质中,O2-向?(填“正”或“负”)极移动,电池负极电极反应为:? ?;
(3)如图是一个电化学装置示意图。用CH3OH-空气燃料电池做此装置的电源。如果A是铂电极,B是石墨电极,C是CuSO4溶液,通电一段时间后,向所得溶液中加入8 g CuO固体后恰好可使溶液恢复到电解前的浓度和pH.则电解过程中收集到标准状况下的气体体积为?;
(4)常温下0.01 mol·L-1的氨水中 = 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为?;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1??V2(填“>”、“<”或“=”)。
= 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为?;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1氨水V2 L混合,若混合溶液pH = 7,则V1和V2的关系为:V1??V2(填“>”、“<”或“=”)。