时间:2017-09-23 23:45:53
1、实验题 用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: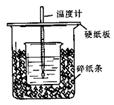
(1)从实验装置上看,图中尚缺少的一种玻璃仪器的名称是?。
(2)烧杯间填满碎纸条的作用是?。
(3)大烧杯上如不盖硬纸板,求得的中和热数值?(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量?(填“相等、不相等”),所求中和热?(填“相等、不相等”)。
参考答案:(1)环形玻璃搅拌棒(2)减少热量散失(3)偏小(4)不相等、相等
本题解析:考查中和热的测定,主要是注意热量的损耗,尽量减小误差。
(4)参加反应的物质的量不同,放出的热量必然不同,但经折算为中和热后应相等。
本题难度:一般
2、选择题 常温下,在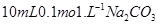 ?溶液中逐滴加入
?溶液中逐滴加入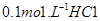 溶液20mL, 溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(ω)变化如右图所示(CO2因逸出未画出),下列说法正确的是
溶液20mL, 溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(ω)变化如右图所示(CO2因逸出未画出),下列说法正确的是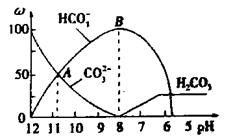
A.在0.1mo1/L Na2CO3溶液中: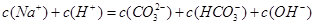
B.当溶液pH为7时,溶液的总体积为20mL
C.在B点所示的溶液中,阳离子浓度最大的是Na
D.在 A点所示的溶液中: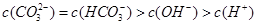
参考答案:CD
本题解析:A不正确,不符合电荷守恒,应该是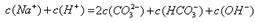 ;如果盐酸是10ml,则恰好生成碳酸氢钠,溶液应该是显碱性的,B不正确;B点对应的是碳酸氢钠,阳离子浓度最大的是是钠离子,C正确;A点碳酸钠和碳酸氢钠的物质的量相同,溶液显碱性,正确,答案选CD。
;如果盐酸是10ml,则恰好生成碳酸氢钠,溶液应该是显碱性的,B不正确;B点对应的是碳酸氢钠,阳离子浓度最大的是是钠离子,C正确;A点碳酸钠和碳酸氢钠的物质的量相同,溶液显碱性,正确,答案选CD。
本题难度:简单
3、选择题 下列溶液中的氯离子数目与50 mL 1 mol·L-1的FeCl3溶液中氯离子数目相等的是(?)
A.50 mL 1.5 mol·L-1的FeCl2溶液
B.100 mL 3 mol·L-1的NH4Cl溶液
C.75 mL 3 mol·L-1的KCl溶液
D.50 mL 2 mol·L-1的CaCl2溶液
参考答案:A
本题解析:根据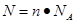 可知,氯离子数目相等,则氯离子的物质的量也是相等的。50 mL 1 mol·L-1的FeCl3溶液中氯离子的物质的量是0.05L×1mol/L×3=0.15mol,而选项中氯离子的物质的量分别是0.15mol、0.3mol、0.225mol、0.2mol,所以答案选A。
可知,氯离子数目相等,则氯离子的物质的量也是相等的。50 mL 1 mol·L-1的FeCl3溶液中氯离子的物质的量是0.05L×1mol/L×3=0.15mol,而选项中氯离子的物质的量分别是0.15mol、0.3mol、0.225mol、0.2mol,所以答案选A。
点评:该题是基础性试题的考查,也是高考中的常见考点。试题基础性强,主要是考查学生对以物质的量为核心的有关计算的熟悉掌握程度。该题的关键是明确溶液中离子的浓度与物质浓度的关系,特别是要注意,要求计算的是浓度还是物质的量。
本题难度:简单
4、选择题 常温下pH=3的盐酸与pH=9的NaOH溶液等体积混合(假设体积等于混合前两溶液体积和),混合溶液中c(H+)的计算式是
A.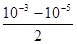 mol·L-1
mol·L-1
B.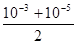 mol·L-1
mol·L-1
C.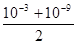 mol·L-1
mol·L-1
D.以上计算式都不对
参考答案:A
本题解析:根据题意盐酸的浓度是10-3mol/L,氢氧化钠溶液的浓度是10-5mol/L,则反应后盐酸是过量的,所以混合溶液中c(H+)的计算式是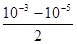 mol/L,答案选A。
mol/L,答案选A。
点评:该题是高考中的常见题型,属于基础性试题的考查,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力。该题的关键是首先判断出酸碱的过量问题,然后再结合题意灵活运用即可。
本题难度:简单
5、选择题 下列说法正确的是(? )
A.pH=2的溶液中的c(H+)是pH=4的溶液中的c(H+)的2倍
B.等浓度的Na2CO3溶液的pH大于NaHCO3溶液的pH
C.25℃时纯水的pH低于100℃时纯水的pH
D.pH=3的硫酸溶液中的c(H+)是pH=3的盐酸溶液中c(H+)的2倍
参考答案:B
本题解析:
正确答案:B
A.不正确,pH=2的溶液中的c(H+)=10-2mol/L是pH=4的溶液中的c(H+)=10-4mol/L的100倍
B.正确,等浓度的Na2CO3溶液的pH大于NaHCO3溶液的pH
C.不正确,25℃时纯水的pH=7高于100℃时纯水的pH=6
D.不正确,pH=3的硫酸溶液中的c(H+)与pH=3的盐酸溶液中c(H+)相等。
本题难度:一般