时间:2017-09-23 23:44:32
1、填空题 下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的14种元素中,化学性质最不活泼的是______(用元素符号表示,下同),非金属性最强的是______,属于过渡元素的是______(该空用字母表示).
(2)除稀有气体外第三周期中原子半径最小的是______(填元素符号),
| 1 | 2 | D B A 3 J I H C G F E 4 L K N 5 M 6 | ||||||||||||||||||||||||||
参考答案:(1)同主族元素从上到下元素的非金属性逐渐减弱,金属性逐渐增强,同周期元素从左到右元素的非金属性逐渐增强,金属性逐渐减弱,则非金属性最强的元素为于第二周期第ⅦA族,为F元素,最不活泼的元素位于0族,为Ar元素;因过渡元素包括副族和ⅥⅡ族,所以M为过渡元素;
(2)根据原子半径的递变规律判断,同一周期,原子半径从左到右逐渐减小,则原子半径最小的为Cl;
(3)同主族元素从上到下元素的非金属性逐渐减弱,非金属性越强的元素,对应的最高价氧化物对应水化物的酸性越强,氢化物的稳定性越强,F的非金属性最强,氢化物的稳定性越强的是HF,因F无正价,所以酸性最强的HClO4,同主族元素从上到下元素的金属性逐渐增强,金属性越强的元素,对应的最高价氧化物对应水化物的碱性越强,
K的金属性最强,则对应最高价氧化物对应水化物的碱性最强,为KOH,
故答案为:(1)Ar;F;M;
(2)Cl;
(3)HClO4;KOH;HF;
本题解析:
本题难度:一般
2、选择题 下列结论正确的是
[? ]
①微粒半径:S2->Cl>S>F ②氢化物的稳定性:HF > HCl > H2S > H2Te ③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te ⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se
A.②④⑥
B.②③⑥
C.①②③⑥
D.全部
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列各组元素按电负性大小的顺序排列,正确的是
A.F>N>O
B.O>Cl>F
C.As>P>H
D.Cl>S>As
参考答案:D
本题解析:非金属性越强,电负性越大,所以答案选D。
本题难度:简单
4、选择题 氯化溴(BrCl)和Br2、Cl2具有相似的性质,下列有关氯化溴性质的判断中错误的是
[? ]
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列根据实验操作和现象所得出的结论不正确的是?(?)
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 测定等浓度的Na2CO3和Na2SO3 溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | SO2具有还原性 |
| C | 溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| D | 向等浓度的KBr、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgBr)>Ksp(AgI) |
参考答案:A
本题解析:A.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。最高价氧化物对应的水化物的酸性就越强,相应的钠盐溶液的碱性也就越弱。所以应该比较等浓度的Na2CO3和Na2SO4 溶液的pH的大小。Na2SO3不是S的最高价氧化物对应的水化物的钠盐。错误。B. SO2通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色是因为发生反应:5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+.体现了SO2的还原性。正确。C.溴乙烷与NaOH溶液共热后,发生反应CH3CH2Br+NaOH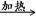 CH3CH2OH+NaBr。再加入HNO3酸化的AgNO3溶液时发生Br-+Ag+=AgBr↓。证明溴乙烷在NaOH的水溶液中发生了水解反应。正确。D.物质越难溶,反应产生沉淀所需要的离子的浓度就越小,就越先反应得到沉淀。Br-+Ag+=AgBr↓;AgBr是淡黄色沉淀,I-+Ag+=AgI↓,AgI是黄色沉淀。向等浓度的KBr、KI混合液中滴加AgNO3溶液,先出现黄色沉淀说明先发生反应I-+Ag+=AgI↓。因此Ksp(AgBr)>Ksp(AgI)。正确。2、溴乙烷的化学性质的知识。
CH3CH2OH+NaBr。再加入HNO3酸化的AgNO3溶液时发生Br-+Ag+=AgBr↓。证明溴乙烷在NaOH的水溶液中发生了水解反应。正确。D.物质越难溶,反应产生沉淀所需要的离子的浓度就越小,就越先反应得到沉淀。Br-+Ag+=AgBr↓;AgBr是淡黄色沉淀,I-+Ag+=AgI↓,AgI是黄色沉淀。向等浓度的KBr、KI混合液中滴加AgNO3溶液,先出现黄色沉淀说明先发生反应I-+Ag+=AgI↓。因此Ksp(AgBr)>Ksp(AgI)。正确。2、溴乙烷的化学性质的知识。
本题难度:一般