时间:2017-09-23 23:38:40
1、简答题 目前世界上60%的镁是从海水提取的.海水提镁的主要流程如下:
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是______,写出在沉淀池的离子方程式______.
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的______.
(3)操作A是______,操作B是______.
(4)加入的足量试剂a是______(填化学式).
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为______.从考虑成本和废物循环利用的角度,副产物氯气可以用于______.
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?______.
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你______(填“同意”或“不同意”)该同学的想法,理由是______.
参考答案:(1)镁离子能与氢氧根离子反应生成氢氧化镁沉淀:Mg2++2OH-=Mg(OH)2↓,写离子方程式时氢氧化镁沉淀写化学式,
故答案为:沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀);Mg2++2OH-═Mg(OH)2↓;
(2)贝壳或牡蛎壳的主要成分为碳酸钙,
故答案为:贝壳(或牡蛎壳等)
(3)分离不溶于水的固体和液体,可用过滤的方法,从沉淀池中得到氢氧化镁用过滤的方法,从氯化镁溶液中得到六水合氯化镁,防结晶水损失,通过加热浓缩或蒸发结晶的方法获得六水合氯化镁,
故答案为:过滤;?加热浓缩(或蒸发结晶);
(4)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,加入的足量试剂a是HCl,
故答案为:HCl;
(5)无水MgCl2在熔融状态下,通电后阳极氯离子失去电子生成氯气,阴极镁离子得到电子生成镁单质,所以氯化镁电解会产生Mg和Cl2,副产物氯气和氢气反应生成氯化氢,能循环使用,
故答案为:MgCl2(熔融)?通电?.??Mg+Cl2↑,制盐酸,循环使用;
(6)将海水中的氯化镁含量大,由于未富集,镁离子浓度很低,直接加热浓缩提取须消耗大量的电能,成本高,且提取的氯化镁盐中混有大量的其它氯化钠盐等离子,所以须将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁,
故答案为:海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低.
(7)MgO熔点为3105℃,MgCl2熔点714℃,熔融MgO时耗费大量的能量,而增加生产成本,
故答案为:不同意;?MgO熔点很高,熔融时耗费大量的能量而增加生产成本;
本题解析:
本题难度:一般
2、选择题 环境与可持续发展是现在国际性环保的主题,利用海水是可持续发展的一个任务,对于海水的利用认识错误的是( ? )
A.海水中有大量人类需要的物质,人类可以大量开发海水中的物质,以满足资源短缺的问题
B.海水可以成为廉价的能源基地,但不能开发过度,要适度使用和开发
C.可以用太阳能电解海水以获取氢能源
D.人类在利用海水时要兼顾海洋生物和海洋生态平衡
参考答案:A
本题解析:
本题难度:简单
3、简答题 南通濒江临海,有较长的海岸线,海洋资源十分丰富.
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、______、______可制得精盐.
(2)目前世界上60%的镁是从海水中提取的.其主要步骤如下: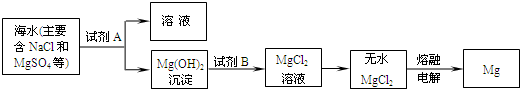
①提取Mg的过程中,试剂A可以选用______,试剂B选用______,由无水MgCl2制取Mg的反应类型为______.
②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去______;加入过量Na2CO3溶液的目的是______.
(3)目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是______.
参考答案:(1)粗盐提纯的主要步骤是:溶解、过滤、蒸发,故答案为:过滤;蒸发;
(2)①MgSO4与Ca(OH)2反应:MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4,Mg(OH)2与HCl反应:Mg(OH)2+2HCl=MgCl2+H2O,无水MgCl2制取Mg的反应:MgCl2(熔融)?电解?.?Mg+Cl2↑,是分解反应,
故答案为:氢氧化钙溶液;盐酸;分解反应;
②钡离子可以和硫酸根反应生成沉淀,碳酸根离子可以把过量的钡离子转化为沉淀,同时能够和钙离子结合生成沉淀,
故答案为:Na2SO4;除去CaCl2和过量的BaCl2;
(3)检验氯离子的方法:取样并滴加AgNO3溶液,若没有白色沉淀,说明无氯离子,证明蒸馏得到的水为淡水即证明水中无氯离子,故答案为:取样并滴加AgNO3溶液,若没有白色沉淀,说明蒸馏海水为淡水.
本题解析:
本题难度:一般
4、填空题 目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下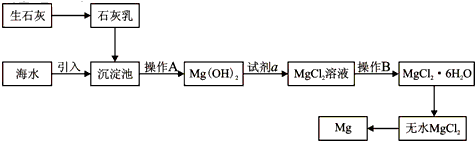
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是_______________________,写出在沉淀池的离子方程式_____________________。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的_________________。
(3)操作A是_______________, 操作B是__________________。
(4)加入的足量试剂a是__________________(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为___________________。从考虑成本和废物循环利用的角度,副产物氯气可以用于_________________。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
_________________________。
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你______________(填“同意”或“不同意”)该同学的想法,理由是
_______________________。
参考答案:(1)沉淀Mg2+ (或使Mg2+形成Mg(OH)2沉淀);Mg2++2OH-==Mg(OH)2↓
(2)贝壳(或牡蛎壳等)
(3)过滤;加热浓缩(或蒸发结晶)
(4)HCl
(5)MgCl2(熔融) Mg+Cl2↑;制盐酸,循环使用
Mg+Cl2↑;制盐酸,循环使用
(6)海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低
(7)不同意;MgO熔点很高,熔融时耗费大量的能量而增加生产成本
本题解析:
本题难度:困难
5、选择题 海水是一个巨大的化学资源库,下列有关海水综合利用的说法中,正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到单质钾
B.海水蒸发制盐的过程中只发生了化学变化
C.从海水中除得到氯化钠外,还可用其作原料制得纯碱、烧碱、金属钠及氯气、盐酸等含氯化产品
D.利用潮汐发电是将化学能转化为电能
参考答案:C
本题解析:
本题难度:一般