时间:2017-09-23 23:37:58
1、选择题 下列分子中属于非极性分子的是(?)
A.HF
B.H2O2
C.CO2
D.NH3
2、选择题 据最新报道,科学家发现了如下反应:O2+PtF6===O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
[? ]
A.在此反应中,O2是氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1?mol?O2(PtF6)则转移1?mol电子
D.在O2(PtF6)中不存在共价键
3、选择题 下列物质中,既含有离子键又含有非极性键的是( )
A.CO2
B.MgCl2
C.KOH
D.Na2O2
4、选择题 下列分子中的化学键既有极性键又有非极性键的是( )
A.CH3COONH4
B.Cl2
C.NH3
D.N2H4(分子中各原子均达到稳定结构)
5、选择题 下列有关化学用语正确的是( )
A.Cl-离子的结构示意图:
B.玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO?5MgO?8SiO2?H2O
C.NaOH的电子式: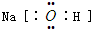 ]
]
D.丙烯的结构简式:CH2CHCH3