时间:2017-09-23 23:32:52
1、计算题 某元素的同位素AZX,它的氯化物XCl21.11g溶于水制成溶液后,加入1mol/LAgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值和A值;
(2)X元素在周期表中的位置,写出其电子排布式;
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。
参考答案:(1)Z=20;A=40
(2)第4周期第IIA族;1s22s22p63s23p64s2
(3)与水剧烈反应有气泡生成;Ca+2H2O==Ca(OH)2+H2↑
本题解析:
本题难度:一般
2、选择题 下列有关元素性质的递变规律不正确的是
A.Na、Mg、Al的还原性逐渐减弱
B.HCl、PH3、H2S的稳定性逐渐减弱
C.NaOH、KOH、RbOH的碱性逐渐增强
D.Cl、Br、I的原子半径逐渐增大
参考答案:B
本题解析:根据周期表中同周期、同主族元素的性质递变规律来分析解答.同周期元素,从左到右,元素的金属性逐渐减弱,则选项A说法正确;同周期元素,从左到右,气态氢化物的稳定性逐渐增强,则依HCl、H2S、PH3的顺序稳定性逐渐减弱,选项B说法错误;同主族元素,从上到下,最高价氧化物的水化物的碱性逐渐减弱,选项C说法正确;同主族元素,从上到下,元素的原子半径逐渐增大,选项D说法正确.
本题难度:一般
3、选择题 核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象
[? ]
A.
B.
C.元素周期表中VA族所有元素的原子
D.元素周期表中第1周期所有元素的原子
参考答案:C
本题解析:
本题难度:一般
4、选择题 若短周期中的两元素可以形成化合物X2Y3,则这两种元素的原子序数之差不可能是
[? ]
A.1
B.3
C.5
D.6
参考答案:D
本题解析:
本题难度:简单
5、推断题 A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素。A是元素周期表所有元素中原子半径最小的;B和C 都只有两个电子层,B中一层电子数是另一层的两倍;C 中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和;E 核外各层电子数两两相等。请按要求回答下列问题:
(1)画出E的离子结构示意图_________,写出由A 和C组成的含有非极性键的化合物的电子式_________。
(2)由上述元素组成的化合物中属于极性键构成的非极性分子是_________。(只要求写出两种,用化学式表示)
(3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式__________________
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:__________________
(5)上述元素形成的化合物中通常能污染空气的是_________(至少写出两种)。某一种可污染空气的化合物与强氧化剂单质常温下反应生成两种化合物,该反应的化学方程式为: __________________
参考答案:(1) ;
;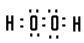 ?
?
(2)CH4、CO2、CS2(任意两种即可)
(3)CaO+3C CaC2+CO?
CaC2+CO?
(4)Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓
(5)CO、SO2、H2S等;H2S +O3=SO2+H2O
本题解析:
本题难度:一般