时间:2017-09-23 23:19:35
1、填空题 (1)人类的生活和生产活动,可以说都离不开能源。在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是 ;属于“不可再生能源”的是 。(填序号)
(2)甲、乙两种金属: ①甲单质能与乙盐的溶液反应; ②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙; ③分别与氯气反应生成金属阳离子时,甲失去电子数比乙多;④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气。其中一定能说明甲的金属性比乙强的有 。(填序号)
(3)某温度时,在2 L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示。由图中所给数据进行分析,该反应的化学方程式为 ;反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ;反应达到平衡时,Y的浓度为 。
参考答案:(每空1分,共6分。答不全或有错误选项的不得分,不写单位或单位写错不得分。)
(1)②⑧; ①④⑤ (2)④
(3)3X+Y 2Z(不用可逆符号不得分); 0.05mol/(L·min); 0.45mol/L。
2Z(不用可逆符号不得分); 0.05mol/(L·min); 0.45mol/L。
本题解析:(1)二级能源是指需要依靠其它能源(也就是一级能源)的能量间接制取的能源,电能、水煤气均属于“二级能源”,不可再生能源泛指人类开发利用后,在现阶段不可能再生的能源资源,如石油、煤炭、天然气等,故属于“二级能源”的是②⑧,属于“不可再生能源”的是①④⑤。
(2)④乙单质表面生成氢气,说明乙是正极,即甲的金属性大于乙的金属性。故选④
(3)根据化学计量数之比等于反应的物质的量之比,故方程式为3X+Y 2Z。
2Z。
v(Z)=△c(Z)÷t=△n(Z) ÷V÷t=0.2mol÷2L÷2min=0.05mol/(L·min)。
平衡时,Y的物质的量为0.9mol,体积为2L,浓度为0.9mol/2L=0.455mol/L。
考点:常见能源的种类及其工作原理 金属性强弱比较 化学反应速率和化学平衡
点评:本题考查学生二级能源和不再生能源的概念,可以根据所学知识进行回答,难度不大。
本题难度:一般
2、选择题 用惰性电极电解下列溶液,一段时间后,再加入一定质量的某种物质(小括号内),溶液能与原来溶液完全一样的是?( )
A.CuCl2(CuSO4)
B.NaOH?(NaOH)?
C.NaCl?(HCl气体)
D.CuSO4[Cu(OH)2]
参考答案:A.电解CuCl2溶液,阳极氯离子放电,阴极铜离子放电,即电解物质为CuCl2,恢复原样,应加入CuCl2,故A错误;
B.电解NaOH溶液,阳极氢氧根离子放电,阴极氢离子放电,即电解物质为水,恢复原样,应加入水,故B错误;
C.电解NaCl溶液,阳极氯离子放电,阴极氢离子放电,即电解物质为HCl,恢复原样,应加入HCl,故C正确;
D.电解CuSO4溶液,阳极氢氧根离子放电,阴极铜离子放电,一段时间后恢复原样,应加入CuO,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 如图某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用硫酸钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔知滤纸上写“嫦娥奔月”,会出现红色字迹,据此下列叙述正确的是( )
A.铅笔端作阴极,铂片端发生还原反应
B.铅笔端有少量钠生成
C.硫酸钠溶液不可用硝酸钾溶液代替
D.铂片端发生的电极反应为:40H--4e-=2H2O+O2↑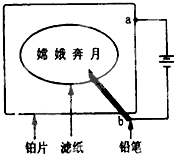
参考答案:A、阴极发生还原反应,阳极发生氧化反应,在该电解池中,铅笔做阴极,铂片做阳极发生氧化反应,故A错误;
B、此为电解硫酸钠溶液的实验装置,电解总反应为2H2O电解.O2↑+2H2↑,电解时不会生成Na,故B错误;
C、电解硫酸钠溶液和硝酸钾溶液时,均是电解的水,所以硫酸钠溶液可用硝酸钾溶液代替,故C错误;
D、铂片做阳极,阳极上氢氧根离子失电子生成氧气和水,其电极反应式为:40H--4e-=2H2O+O2↑,故D正确;
故选:D.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是(?)
A.燃料电池是一种高效但是会污染环境的新型电池
B.锌锰干电池是二次电池
C.化学电池的反应基础是氧化还原反应
D.电池工作时电流由负极流向正极
参考答案:C
本题解析:燃料电池高效,但没有污染。锌锰干电池不能反复充放电,是一次电池。在原电池中电子通过短线从负极传递到正极,电流反向正好相反。答案是C。
本题难度:一般
5、填空题 将铁片和铜片插入某种电解质溶液,铁片和铜片用导线相连,形成原电池装置.
(1)若电解质溶液是稀硫酸,则负极材料是______,发生______反应;正极上反应的电极反应式是______,该电池的总反应方程式是______.
(2)若电解质溶液是浓硝酸,在导线中电子是由______极流向______极(“铁”、“铜”),负极上反应的电极反应式是______,该电池总反应离子方程式是______.
参考答案:(1)铁片和铜片与稀硫酸组成的原电池中,铁作负极,负极上失电子发生氧化反应;正极上发生得电子的还原反应,溶液中的氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,所以正负极上的电极反应式相加得电池反应式,所以电池反应式为Fe+H2SO4=FeSO4+H2↑;
故答案为:铁片;氧化;2H++2e-=H2↑;Fe+H2SO4=FeSO4+H2↑;
(2)铁和浓硝酸发生钝化现象,阻止了铁与硝酸的反应,铜失电子发生氧化反应作负极,铁作正极,所以铜极流向铁极;负极上铜失电子生成铜离子,所以电极反应式为Cu-2e-=Cu2+;正极上硝酸得电子生成一氧化氮气体和水,所以电池反应式为Cu+4H++2NO3-=Cu2++2NO↑+2H2O.
故答案为:铜;铁;Cu-2e-=Cu2+;Cu+4H++2NO3-=Cu2++2NO↑+2H2O.
本题解析:
本题难度:一般