时间:2017-09-23 23:17:54
1、选择题 在硫酸铁溶液中,加入a g 铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是?
A.最后得到的溶液中不含有Cu2+
B.残余固体一定全部是铜
C.最后得到的溶液中只含Cu2+
D.残余固体可能为铁、铜混合物
参考答案:D
本题解析:由于b小于c,所以最终所得的固体一定含有铜,但也可能含有铁,因此选项D正确,其余都是错误的,答案选D。
本题难度:一般
2、选择题 把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉质量相等,则原溶液中H+和SO42-的物质的量之比为
A.1∶4
B.2∶7
C.1∶2
D.8∶31
参考答案:A
本题解析:投入铁粉后发生的反应为Fe+2H+=Fe2++H2↑、Fe+Cu2+=Fe2++Cu,由于残余固体的质量与原来加入的铁粉质量相等,因此置换出的铜和参加反应的铁的质量是相同的。若设置换出了xmol铜,则和铜离子反应的铁是xmol,则与氢离子反应的铁是 。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是
。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是 和xmol,所以原溶液中H+和SO42-的物质的量之比为
和xmol,所以原溶液中H+和SO42-的物质的量之比为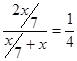 。所以答案是A。
。所以答案是A。
本题难度:一般
3、选择题 为了除去Fe2(SO4)3溶液中混有的少量FeSO4,最好的方法是向此溶液中
A.通入氯气
B.加入H2O2
C.加入Fe
D.加入KMnO4
参考答案:B
本题解析:A错误,通入氯气会引入新的杂质。
B正确,双氧水具有强氧化性,可以将+2价铁氧化成+3价,而还原产物是水,没有新杂质。
C错误,铁粉的加入会还原部分+3价铁,导致杂质增加。
D错误,KMnO4虽然可以氧化+2价铁,但同时也引入了新的杂质。
本题难度:简单
4、简答题 工业上用铝土矿(主要成分是A1203,还有少量的Fe203,SiO2)提取冶炼铝的原料氧化铝.工艺流程图如图: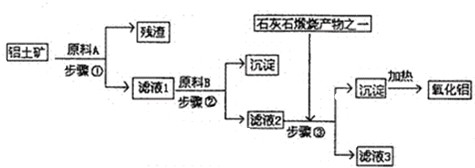
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______.步骤②反应的离子方程式是:______.
(3)步骤③的离子化学方程式是:______.
(4)步骤①②③的操作都是______(填操作名称),要检验Al(OH)?3沉淀是否完全的方法是______.
(5)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?______.
参考答案:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液2含有AlO2-.步骤②应加入氢氧化钠,所以滤液1中含有Al3+,步骤①应为加入盐酸,除去SiO2.
(1)由上述分析可知,步骤①加入盐酸,除去SiO2,所以原料A为盐酸,
氧化铝与酸反应离子方程式为Al2O3+6H+=2Al3++3H2O,氧化铁与盐酸反应离子方程式为Fe2O3+6H+=2Fe3++3H2O.
故答案为:Al2O3+6H+=2Al3++3H2O;Fe2O3+6H+=2Fe3++3H2O.
(2)步骤①加入过量盐酸,滤液1中含有Al3+、Fe3+、H+等,应加入氢氧化钠,除去铁离子,将铝离子转化为AlO2-,反应为?H++OH-=H2O,Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O.
故答案为:NaOH;?H++OH-=H2O、Fe3++3OH-=Fe(OH)3、Al3++4OH-=AlO2-+2H2O.
(3)滤液2含有AlO2-,步骤③通入二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,
反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3.
(4)由工艺流程可知步骤①②③的操作都是过滤.检验Al(OH)?3沉淀是否完全,只要检验滤液3中是否含有AlO2-即可.取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全.
故答案为:过滤;取滤液3的上层清液,通入二氧化碳,若出现浑浊,则说明沉淀不完全;若不出现浑浊,则说明沉淀完全.
(5)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质.
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质.
本题解析:
本题难度:一般
5、选择题 某同学设计如下实验测量m g铜银合金样品中铜的质量分数: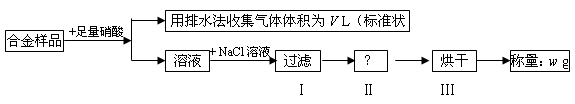
下列说法中不正确的是
A.收集到的V L气体为 NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为: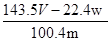 ×100%
×100%
参考答案:D
本题解析:铜和银与硝酸反应,生成NO2或NO,但通过排水法收集到的气体是NO。溶液中加入氯化钠生成氯化银沉淀,即氯化银的质量是wg。所以根据原子守恒可知,合金中银的质量是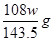 ,则铜的质量分数为
,则铜的质量分数为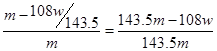 ,即选项D是错误的,其余都是正确的,答案选D。
,即选项D是错误的,其余都是正确的,答案选D。
本题难度:一般