时间:2017-09-23 23:17:54
1、选择题 在含有硝酸铜、硝酸铁、硝酸银各0.1 mol的混合溶液中加入铁粉,充分反应后,析出3.2 g铜,则向溶液中加入的铁粉质量为? ( )
A.5.6 g
B.2.8 g
C.8.4g
D.14 g
参考答案:C
本题解析:由阳离子的氧化顺序可知,铁依次发生如下反应:
Fe+2Ag+=Fe2++2Ag ?2Fe3++Fe=3Fe2+? Fe+Cu2+=Cu+Fe2+
由于最终析出3.2 g铜,也就是说前两个反应已经进行完全,而铜只有一半参加了反应,所以共消耗铁粉为:0.05+0.05+0.05=0.15mol,即共8.4g
答案为C
本题难度:简单
2、选择题 把表面有少量氧化物的铜片和铁片一起放入足量盐酸中充分反应,在该溶液中的金属离子是
[? ]
参考答 案:A
本题解析:
本题难度:一般
3、实验题 某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1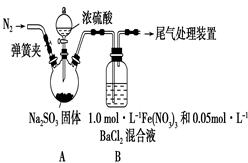
请回答:
(1)装置A中反应的化学方程式是______________________________;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是_______________________________;
(3)装置B中产生了白色沉淀,其成分是________;
(4)分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+、酸性条件下NO3-都反应;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3-反应;
①按猜想2,装置B中反应的离子方程式是_________,证明该猜想正确应进一步确认生成了________;
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________(填字母)。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
参考答案:(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O (2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹 (3)BaSO4 (4) ①SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+(可分两步写SO2+2Fe3++2H2O=2Fe2++SO42-+4H+、SO42-+Ba2+=BaSO4↓) Fe2+ ②c
本题解析::(l)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,故答案为:Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O;(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,故答案为:BaS04;还原性;(4)假设一 两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3-都反应,故答案为:SO2和Fe3+、酸性条件下NO3-都反应;①按观点2,装置B中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点2合理,故答案为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;②按观点3,在酸性条件下SO2与NO3-反应,实验中c(NO3-)=3mol/L,则可用6.0mol?L-1NaNO3和0.2mol?L-1盐酸等体积混合的溶液代替,故选c.
本题难度:困难
4、实验题 (16分)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
Ⅰ.定性检验
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热。 | 黑色粉末逐渐溶解,有无色气体逸出。 |
| ② | 向试管1所得溶液中滴加几滴 KSCN溶液,振荡。 | 溶液未出现血红色 |
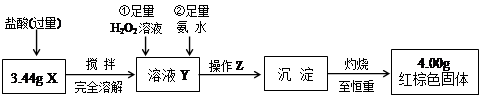

参考答案:(1)否(2分)?(2)Fe3O4 + 8H+ ="==" Fe2+?+ 2Fe3+ + 4H2O;(2分)
Fe + 2H+ ="==" Fe2+?+ H2↑(2分);? 2Fe3+ + Fe ="==" 3Fe2+?(2分)
(3)过滤,洗涤(2分);?坩埚、泥三角(2分)。
(4)n(Fe3O4)=" 0.0100" mol (2分)? n(Fe)=" 0.0200" mol(2分)
(无保留3位有效数字每空得1分)
本题解析:(1)由于在单质铁的存在下,铁离子是不可能存在的,所以不能确定是否含有四氧化三铁。
(2)有无色气体逸出,说明含有单质铁,反应的方程式是Fe + 2H+ ="=" Fe2+?+ H2↑;又因为还可能存在四氧化三铁,所以还可能发生的反应是Fe3O4 + 8H+ ==Fe2+?+ 2Fe3+ + 4H2O、2Fe3+ + Fe ="==" 3Fe2+。
(3)沉淀从溶液中分离出的方法是过滤,且在过滤之后还必需洗涤;固体的灼烧需要坩埚,而坩埚需要放在三脚架的泥三角上。
(4)设混合物中四氧化三铁和铁的物质的量分别是x和y。由于最终得到的是氧化铁,所以应该有232x+56y=3.44、(3x+y)×160=4.00,解得x=0.0100 mol,y=0.0200 mol,即铁是0.0200 mol,四氧化三铁是0.0100 mol。
本题难度:一般
5、填空题 高铁酸钠的化学式为Na2FeO4,按要求回答下列问题:
(1)高铁酸钠主要通过如下反应制取: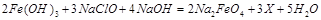 ,则X的化学式为?。
,则X的化学式为?。
(2)高铁酸钠是一种新型净水剂,在水中可以发生如下反应: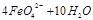

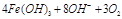 。由此看来,高铁酸钠能够杀菌消毒是因为它具有?性,而能够除去水中悬浮物是因为?。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有?性,而能够除去水中悬浮物是因为?。
(3)FeO42-在水溶液中的存在形态如图所示。向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为?。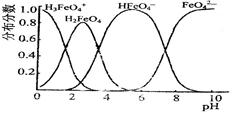
(4)高铁电池是一种新型可充电电池,电解池为碱溶液,其反应式为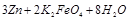 ?
? ?
?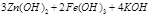 则电池正极材料是?,充电时电池正极?(填“得”“失”)电子,放电时电池的负极反应式为?。
则电池正极材料是?,充电时电池正极?(填“得”“失”)电子,放电时电池的负极反应式为?。
参考答案:C
本题解析:(1)由质量守恒定律可得X为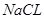 ;
;
(2)高铁酸钠能够杀菌消毒是因为它具有强氧化性,能杀菌、消毒;而能够除去水中悬浮物是因为反应生成氢氧化铁胶体,能够吸附水中的悬浮杂质;
(3)离子方程式为: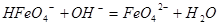 ;
;
(4)由总方程式可知,电池正极材料为: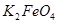 ;充电时电池正极得一电子,放电时电池的负极反应式为:
;充电时电池正极得一电子,放电时电池的负极反应式为: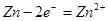 ;
;
本题难度:一般