时间:2017-09-23 23:17:54
1、选择题 下列有关铁元素的叙述中正确的是(?)
A.通过化合反应可制得FeCl2和Fe(OH)3
B.铁是较活泼的金属,不能用铁质容器储存、运输浓硝酸、浓硫酸
C.不锈钢是铁的合金,只含金属元素
D.Fe3O4俗称铁红
2、填空题 (12分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
⑴用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
⑵除去蒸馏水中溶解的O2常采用________的方法。
⑶?生成白色Fe?(OH?)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________________。
方法二:如右图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
⑷在试管Ⅰ里加入的试剂是____________。
⑸在试管Ⅱ里加入的试剂是____________。
⑹这样生成的Fe?(OH?)2沉淀能较长时间保持白色,其理由是____________________________。
3、填空题 某不锈钢(主要成分为Fe)样品中含有铝、铜、硅等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程: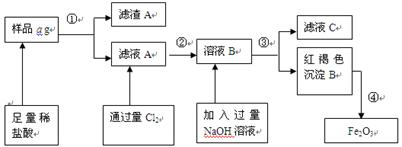
(1)取样品a g,称取时使用的主要仪器名称为_____?_______。
(2)滤液A中溶质主要含有_______??、__? __ _(写化学式);
操作①的名称?,其使用的玻璃仪器有______________________________。
(3)写出由溶液B生成红褐色沉淀B的离子方程式________________________________。
(4) 对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素的质量百分数的表达式为(用含a、b的式子表示)_____________。
(5)如何验证滤液A中含Fe2+,而不含Fe3+______________________?_____________。
4、选择题 为研究铁及其化合物的性质,某探究小组进行如下实验:将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间,取适量浸泡后的溶液滴入少量KSCN溶液,未见溶液呈血红色。请根据要求回答问题:
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应。
①铁锈与稀硫酸反应的化学方程式为__________________________。
②“还发生另一个反应”对应的离子方程式应为______________________________。
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中。
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,____________________ __________________________。 | __________________ __________________ _________________。 | 乙同学的观点____________ (填“正确”或“错误”)。 |
5、选择题 在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3②Fe2O3③Cu(NO3)2④KNO3,铜粉溶解的是(? )
A.只有①或②
B.只有②或④
C.只有①或②或③
D.上述四种物质中任意一种