时间:2017-09-23 23:13:29
1、实验题 用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是____________________
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH___________1(选填>、<、=)乙方案中,说明HA是弱电解质的现象是__________(多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处____________________、____________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
________________________________________
参考答案:(1)100mL容量瓶
(2)>;b
(3)配制pH=1的HA溶液难以实现;不妥之处在于加入的锌粒难以做到表面积相同
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质
本题解析:
本题难度:一般
2、实验题 (14分)
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验: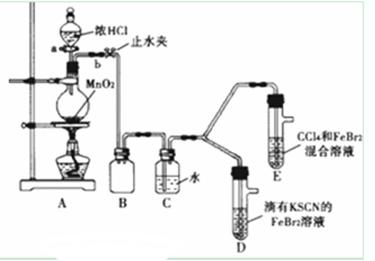
(1)? ①检查气体发生装置A的气密性的操作是:____________
②整套实验装置存在一处明显不足,请指出_____________.
(2)?用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄振荡后CCl4层无明显变化 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ______________________ |
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
参考答案:(1)①关闭活塞A,打开止水夹B,将长导管末端浸入水中,用手捂住圆底烧瓶,管口有气泡产生;松开手后,有水进入导管,则气密性良好。②缺少尾气处理装置。
(2)Cl2> Br2 > Fe3+
(3)①过量氯气和SCN-反应:2SCN-+Cl2=2Cl+(SCN)2,,使SCN- 浓度减小,则使Fe3+
+3SCN- ="=" Fe(SCN)3平衡向逆反应方向移动而褪色。
检验方法为:取少量褪色后的溶液,滴加KSCN?溶液,若溶液变红色,则上述推理合理;或取少量褪色后的溶液,滴加Fe Cl3溶液,若溶液不变红,则上述推理合理
②BrCl+H2O=HBrO反应产生 Cl-由于AgBrO易溶于水,加入 AgNO3溶液,只能生成AgNO3沉淀
③BrCl+2KI=KCl+KBr+I2
本题解析:(1) ②氯气有毒不能直接排空,且如果氯气有剩余会导致D和E装置中气体压强增大,导致安全事故的发生,所以该实验装置的缺点为:缺少尾气处理装置。
(2)D装置中:溶液变红,说明有铁离子生成,据此得出氯气的氧化性大于铁离子;
E装置中:水层溶液变黄,振荡后CCl4层无明显变化,说明氯气和溴离子不反应,
根据D和E装置知,溴的氧化性大于铁离子,则氧化性强弱顺序是?Cl2>Br2>Fe3+,
本题难度:一般
3、实验题 某校化学小组的同学开展K2CO3和NaCl的固体混合物中K2CO3的检验与质量分数测定的探究实验,他们提出下列实验方案。
(一)补全以下检验混合物中存在K2CO3的实验步骤及相关现象
(1)取混合物样品溶于水,分别取少量溶液进行以下实验
(2)_________________________________________则一定存在K+;
(3)___________________________________________________则一定存在CO32—。
(二)测定K2CO3质量分数
(1)甲同学用图1所示装置,把xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时检查该装置气密性的方法是?。
(2)乙同学用图2代替图1中的收集装置,则所测K2CO3质量分数??(填“偏大”、“偏小”、“不变”),你的改进方案是?。
(3)丙同学用图3装置测定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你填写其中的三点缺陷:I?;Ⅱ?;Ⅲ?
参考答案:(一)2.用焰色反应,同时透过钴玻璃片观看燃烧的火焰,如果是紫色的;
3.加入氯化钡溶液有白色沉淀,再加入盐酸沉淀溶解生成无色无味使澄清石灰水浑浊的气体。
(二)(1)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;
(2)偏小;将水换成饱和碳酸氢钠溶液;
(3):①产生的CO2气体中混有水蒸气,同时被碱石灰吸收,导致结果偏大;②反应结束后装置内残留的CO2气体不能全部排出,导致结果偏小;③球形干燥管与空气相通,也会吸收空气中的CO2和水蒸气,导致结果偏大;④实验开始时,装置内的空气中会有部分CO2也会被碱石灰吸收,导致结果偏大等。.
本题解析:(一)钾离子的检验一般用焰色反应,即用焰色反应,同时透过钴玻璃片观看燃烧的火焰,如果是紫色的,说明含有钾离子;CO32-的检验可以氯化钡和盐酸,即加入氯化钡溶液有白色沉淀,再加入盐酸沉淀溶解生成无色无味使澄清石灰水浑浊的气体。
(二)(1)由于有注射器,所以检查该装置气密性的方法是关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位;
(2)由于CO2能溶于水,造成收集的CO2体积减少,所以测定结果偏小;改正的方法是减少CO2的溶解,所以可将水换成饱和碳酸氢钠溶液。
(3)考查实验的评价,根据实验装置图即原理可知,存在的问题是①产生的CO2气体中混有水蒸气,同时被碱石灰吸收,导致结果偏大;②反应结束后装置内残留的CO2气体不能全部排出,导致结果偏小;③球形干燥管与空气相通,也会吸收空气中的CO2和水蒸气,导致结果偏大;④实验开始时,装置内的空气中会有部分CO2也会被碱石灰吸收,导致结果偏大等。
本题难度:一般
4、实验题 已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题
(1)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-还原性强;④HCl比H2S稳定;⑤硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可作为氯元素比硫元素非金属性强的依据的是________。
A.②④?B.②③④⑤?C.②④⑤?D.全部
(2)装有饱和食盐水的洗气瓶的作用是________________
(3)装置B中盛放的试剂是________(填选项),实验现象为_____________?。
A.Na2S溶液?B.Na2SO3溶液?C.Na2SO4溶液
(4)装置B中的溶液在实验后质量增重了0.78g,则在B中反应的气体为________mol
(5)装置C中盛放烧碱稀溶液,目的是吸收剩余气体,防止污染空气。写出反应的离子方程式:____________________。
参考答案:(1)B
(2)为了除去气体中的HCl
(3)A;生成淡黄色沉淀或溶液变浑浊
(4)0.02
(5)Cl2 +2OH-=Cl-+ClO-+H2O
本题解析:
本题难度:一般
5、选择题 下列说法中,正确的是
A.除去液溴中少量的氯水,可向其中加少量KI
B.氯水和氯气均能使湿润的有色布条褪色,都是HClO作用的结果
C.能与硝酸银反应生成白色沉淀的溶液中一定含有Cl—
D.某溶液能使淀粉碘化钾试纸变蓝,则溶液中一定含有Cl2
参考答案:B
本题解析:A项中加入氯水后会引入新的杂质Cl-,故不能选。
B项中氯水和氯气均能使湿润的有色布条褪色,都是Cl2与水作用生成HClO,而HClO具有氧化性,能使有色布条褪色,故B正确。
C项中能与硝酸银反应生成白色沉淀的溶液可能含有Cl—,也可能含有CO32-,故C项错误。
D项中该溶液不一定含有Cl2,还有可能是Br2,故D错误。
点评:本题考查物质的基本性质,属于基础题。注意知识的积累即可解答
本题难度:简单