时间:2017-09-23 23:13:29
1、实验题 下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题: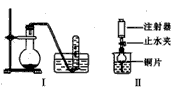
(1)铜与稀硝酸反应的离子方程式_____________________。
(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO气体_____(填“能”或“不能”),简述理由___________________________。
(3)若用Ⅱ实验装置进行实验可证明铜与稀硝酸反应生成的气体是 _______________。在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象_________________________。反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是_______________________________________。
(4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是________________。
参考答案:(1)3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O
(2)不能;因烧瓶内有空气,用排水法收集时,NO与O2生成NO2,NO2又与水反应生成NO
(3)NO;铜片上产生大量无色气泡,管内液面下降,液面上有无色气体;无色气体立即变为红棕色
(4)防止氮的氧化物污染大气
本题解析:
本题难度:一般
2、实验题 某学生设计了如图所示的装置进行实验,各装置中所装试剂、实验操作及实验现象如下:
Ⅰ.装置中所装的试剂是:①A瓶装无水乙醇,内放无水盐X;②B干燥管中装生石灰;③C和D中都装浓硫酸;④E瓶中装入试剂Y
Ⅱ.实验操作及现象是:用水浴加热A瓶;将D中浓硫酸缓缓滴入E中与试剂Y作用;发现C中导管有大量气泡放出;A瓶内X逐渐变色,从B管挥发出的气体可点燃。 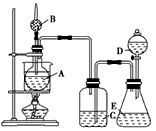
请回答下列问题:
(1)E瓶中所装的试剂Y是________(填写编号)
a.饱和食盐水 b.MnO2和NaCl的混合物 c.浓盐酸
(2)C中浓H2SO4所起的作用是_______________________,D瓶中浓H2SO4所起的作用是________________________________。
(3)A瓶中发生反应的化学方程式是______________________,反应类型是__________,所生成的________________(写名称)在B出口处点燃。
(4)无水盐X宜选用____________,它能起指示剂作用的原因是______________________。
(5)此实验能证明乙醇分子中含有氧原子的理由是________________________。
(6)如果将装置中的C瓶去掉,实验目的是否能够达到?_____(填“能”或“不能”),因为___________________________。
参考答案:(1)c
(2)干燥HCl气体;吸收浓盐酸中混有的水分,浓H2SO4溶于水放热,有利于HCl气体逸出
(3)CH3CH2OH+HCl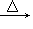 CH3CH2Cl+H2O;取代反应;氯乙烷
CH3CH2Cl+H2O;取代反应;氯乙烷
(4)无水CuSO4;实验过程中观察到无水CuSO4由白变蓝,说明反应中有水生成,与CuSO4结合生成
CuSO4·5H2O
(5)无水CuSO4变蓝证明了反应中一定有水生成,水中的氧元素不能来自于HCl,故只能由乙醇提供
(6)不能;HCl挥发时带出水蒸气,若不除去,无法判定使无水CuSO4变蓝的水是否来自于乙醇
本题解析:
本题难度:一般
3、实验题 (14分)某研究性学习小组设计了如图所示的定量测定装置,其中B是底面积为100cm2、高20cm的圆筒状玻璃容器(带密封盖),上面标有以厘米为单位的刻度。其他夹持装置已略去。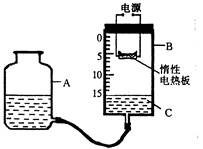
I.甲同学用这套装置测定出了空气中氧气的体积分数,他的操作过程是:
①检查装置的气密性;
②打开B容器密封盖,加入液体C,调整A的高度,使B中液面至刻度15.0cm处;
③将过量的铁粉平铺在电热板上,盖紧容器B的密封盖;
④通电加热铁粉,待充分反应后,冷却到原来的状况,调整A的高度使容器A、B中的液面保持水平,记录液面刻度。
请回答下列问题:
(1)在操作①中检查装置气密性的方法是__________________________? __。
(2)在该同学的实验中,下列物质不能用于代替铁粉的是______。
A .红磷? B.木炭? C.铜粉
(3)在操作④结束时,与装置B中的液面最接近的刻度是______cm(填整数)。
II.乙同学欲用此装置测定铁在氯气中燃烧产物的化学式。他的操作与甲不同之处有:将操作③中铁粉的质量改为1.0g,并使容器B充满氯气后,再盖紧容器。请回答下列问题:
(1)在乙同学的实验中,下列试剂中适合于做液体C的是_______。
A.水? B.氢氧化钠溶液? C.饱和食盐水
(2)实验结束时,液面在刻度8.8cm处。若将当时的实验条件近似看作标准状况,请据此计算生成物FeClx中x的值是______(计算结果保留1位小数)。
(3)上面的实验结果比理论值________(填“偏大”或“偏小”),误差产生的原因可能是____________________________________________________________。
参考答案:.I(1)盖严B容器密封盖,向A中加水,使A中液面高于B中的液面,一段时间后,A、B液面差高度不变,则气密性良好。?(2)B?(3)12
II(1)C?(2)3.1?(3)偏大?氯气溶于水;漏气;读数时A中液面高于B。(其他合理答案也可给分)
本题解析:略
本题难度:一般
4、实验题 (15分)PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
(一)制备
下图是实验室制备PCI3的装置(部分仪器已省略)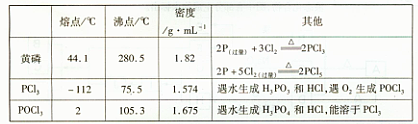
(1)仪器乙的名称?;
(2)实验室制备Cl2的离子方程式:?;
(3)碱石灰的作用是?,?;
(4)向仪器甲中通人干燥Cl2之前,应先通人一段时间的CO2,其目的是?。
(二)提纯
粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过____(填实验操作名称),即可得到PCl3的纯品。
(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500mL溶液,取出2 5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
根据上述数据,该产品中PCl3的质量分数为?(用含字母的代数式表示、不必化简)
参考答案:
本题解析:(一)(1)冷凝管,起冷却回流作用;(2)可用MnO2氧化浓盐酸制Cl2;(3)碱石
灰的作用一方面吸收Cl2,防止污染空气,一方面防止空气中的水进入而使PCl3水解;(4)
因PCl3可被氧气氧化,与水反应,所以整个装置要除氧、除水;(二)根据表中的信息,可
通过蒸馏的方法除去PCl3中的杂质;
(三)根据关系式PCl3~H3PO3~I2可求m(PCl3)=137.5x(c1V1-1/2c2V2)x500/25x10-3。
本题难度:一般
5、实验题 铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法:首先检查制氧气装置的气密性,然后按下图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:
①直形管中用蒸馏水浸过的光亮铁丝表面颜色变 得灰暗,发生锈蚀;
②直形管中干燥的铁丝表面依然光亮,没 有发生锈蚀;
③烧杯中潮湿的铁丝依然光亮。? 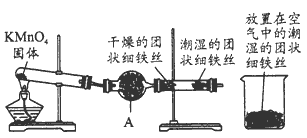
试回答以下问题:
(1)由于接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于____。能表示其原理的反应方程式为___。
(2)仪器A的名称为____,其中装的药品可以是____, 其作用是___。
(3)由实验可知,该类铁生锈的条件为____。决定铁生 锈快慢的一个重要因素是____。
参考答案:(1)电化学腐蚀 ;负极:2Fe-4e-=2Fe2+,正极:2H2O+O2+4e-=4OH-
(2)球形干燥管 ;碱石灰(或无水氯化钙) ;干燥O2
(3)与O2接触、与水接触 ;氧气浓度
本题解析:
本题难度:一般