时间:2017-09-23 23:10:45
1、选择题 某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“ ”。
”。
据此,下列叙述不正确的是(?)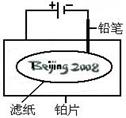
A.铅笔作阴极:电极反应为:2H+ + 2e- = H2↑
B.铂片作阳极:电极反应为:2Cl-- 2e- = Cl2↑
C.铅笔与滤纸接触处有少量Cl2逸出
D.上述反应总的离子方程式可表示为2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
参考答案:C
本题解析:根据装置可知,铅笔和电源的负极相连,做阴极,氢离子放电,生成氢气。从而破坏阴极周围水的电离平衡,使阴极周围溶液显碱性,溶液显红色。珀和电源的正极相连,做阳极,溶液中的氯离子放电,生成氯气。所以选项C不正确,其余选项都是正确的,答案选C。
点评:该题的关键是还是准确判断出阴阳极的放电离子,然后再依据选项分析、判断即可。
本题难度:一般
2、选择题 用质量均为100 g的铜作电极,电解硝酸银溶液,电解一段时间后,两电极的质量差为28 g,此时两电极的质量分别为
A.阳极100 g,阴极128 g
B.阳极93.6 g,阴极121.6 g
C.阳极91.0 g,阴极119.0 g
D.阳极86.0 g,阴极114.0 g
参考答案:B
本题解析:由电极反应:阳极:Cu-2e-=Cu2+?阴极:Ag++e-=Ag
可知阳极质量减轻,而阴极质量增加,由差量法可求解
故最终阳极质量为100-6.4=93.6 g,阴极质量为100+21.6g=121.6g
答案为B
本题难度:一般
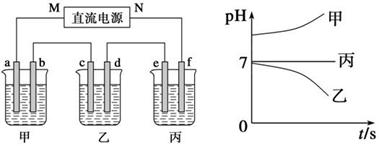
3、填空题 (10分)X、Y、Z三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42—、OH- |
参考答案:(1)负 (1分). (2) 4OH--4e-===2H2O+O2↑(2分).
(3)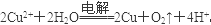 (2分), CuO?(2分).
(2分), CuO?(2分).
(4) e (1分)
水电离产生H+和OH- ,H+得电子变成氢气后e极附近留下大量OH- 呈碱性
(或2H2O + 2e- = H2↑ + 2OH-)。(2分
本题解析:(1)乙中c电极质量增加,说明乙属于阴极,所以b是阳极,a是阴极。则M是负极,N是正极,f是阳极,e是阳极,b是阳极。
(2)甲中pH增大,而丙中pH不变,所以甲是氢氧化钠或氢氧化钾,丙是硫酸钾或硫酸钠。电极b上发生的电极反应为4OH--4e-===2H2O+O2↑。
(3)在所给的离子中只有铜离子可以在溶液中得到电子而析出,所以乙中的电解质一定是硫酸铜,电解的总反应离子方程式为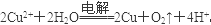 。因为从溶液中出来的是铜氧气,所以需要加入氧化铜。
。因为从溶液中出来的是铜氧气,所以需要加入氧化铜。
(4)丙中阳极f的电极反应式为4OH--4e-===2H2O+O2↑,阴极e的电极反应式为2H++2e-=== H2↑。因为氢离子或OH-的浓度逐渐减小,所以两极周围水的电离都被促进,因此f极周围显酸性,e电极显碱性。所以e极附近变红。
本题难度:一般
4、选择题
如图所示,通电一段时间后,Cu电极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为100 mL,则通电前A池中原混合溶液Cu2+的浓度为
A.0.05 mol/L
B.0.035 mol/L
C.0.025 mol/L
D.0.020 mol/L
参考答案:A
本题解析:
“Cu电极增重2.16 g”那么Cu作阴极,则A池中左电极是阴极,右电极是阳极;结合,Ag++e-=Ag,电极增重2.16 g(即 ),转移电子0.02 mol。A池中,阳极反应为4OH--4e-=2H2O+O 2↑,转移0.02 mol电子,即得n(O2)=0.005 mol,累计收集气体224 mL(即
),转移电子0.02 mol。A池中,阳极反应为4OH--4e-=2H2O+O 2↑,转移0.02 mol电子,即得n(O2)=0.005 mol,累计收集气体224 mL(即 ),那么在阴极还产生0.005 mol H2,阴极反应为2H++2e-=H2↑,转移电子0.01 mol,因此Cu2+放电0.01 mol,Cu2++2e-=Cu,n(Cu2+)=0.005 mol,
),那么在阴极还产生0.005 mol H2,阴极反应为2H++2e-=H2↑,转移电子0.01 mol,因此Cu2+放电0.01 mol,Cu2++2e-=Cu,n(Cu2+)=0.005 mol, 。
。
本题难度:一般
5、选择题 有关X、Y、Z、W四种金属的实验如下: 根据以上事实,下列判断或推测错误的是? 
[? ]
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入CuSO4溶液中一定有Cu析出
D.用Y、Z和稀硝酸可构成原电池,且Y作负极
参考答案:C
本题解析:
本题难度:一般