时间:2017-09-23 23:02:14
1、选择题 下列各选项所描述的两个量中,前者大于后者的是
A.NH4Cl溶液中NH4+和Cl-数目
B.纯水在100℃和25℃时的pH
C.完全中和相同pH且相同体积的氨水和NaOH溶液,所需的0.1mol·L-1盐酸体积
D.CH3COONa溶液加水稀释前后的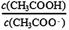
参考答案:C
本题解析:A.NH4Cl是强酸强碱盐,在溶液中NH4+会发生水解反应而消耗,因此NH4+的数目比Cl-数目少,错误;B.纯水在100℃时pH=6,在25℃时的pH=7,前者小,错误; C.由于一水合氨是弱碱,部分电离,所以相同pH且相同体积的氨水和NaOH溶液中溶质的物质的量氨水大于盐酸,所以完全中和相同pH且相同体积的氨水和NaOH溶液,所需的0.1mol·L-1盐酸体积前者大于后者,正确;D.在CH3COONa溶液存在CH3COO-的水解平衡:CH3COO-+ H2O CH3COOH+OH-;加水稀释时平衡正向移动,水解程度增大,前后的
CH3COOH+OH-;加水稀释时平衡正向移动,水解程度增大,前后的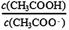 后者大于前者,错误。
后者大于前者,错误。
考点:考查盐的水解、若电解质的电离、溶液的中和能力大小的比较的知识。
本题难度:一般
2、填空题 (8分)⑴浓度均为0.1mol/L的8种溶液:① HNO3 ② H2SO4 ③ CH3COOH ④ Ba(OH)2 ⑤NaOH ⑥ CH3COONa ⑦ KCl ⑧ NH4Cl,溶液pH值由小到大的顺序是(填写编号) ________________。
(2)氯化铝水溶液呈 性,原 因是(用离子方程式表示): ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式)。
因是(用离子方程式表示): ,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 (写化学式)。
参考答案:(8分)
⑴②①③⑧⑦⑥⑤④ (2)酸,Al3++3H2O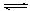 Al(OH)3+3H+,Al2O3
Al(OH)3+3H+,Al2O3
本题解析:略
本题难度:一般
3、选择题 下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)= c(NH4++)=c(Cl-)
B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)+ c(H+)>c(Na+)+c(OH-)
D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+)
参考答案:CD
本题解析:A、25℃时,pH=7的NH4Cl与NH3·H2O混合溶液呈中性,则有c(H+)=c(OH-),由电荷守恒式:c(H+)+ c(NH4+)= c(OH-)+ c(Cl-)知c(NH4+)=c(Cl-),又弱电解质的电离和盐类的水解是微弱的则c(NH4+)=c(Cl-)> c(H+)=c(OH-),错误;B、0.1mol/LNa2S溶液中,根据质子守恒知c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C、25℃时,pH=2的HCOOH与pH=12的NaOH溶液中,c(HCOOH)>c(NaOH),等体积混合后HCOOH远过量,溶液为HCOOH和CH3COONa,呈酸性,结合电荷守恒式知c(HCOO-)+c(H+)>c(Na+)+c(OH-),正确;D、根据物料守恒得2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3(Na+),正确。
考点:考查溶液中离子浓度的大小关系及守恒规律的应用。
本题难度:困难
4、填空题 (1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为 ,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.未用标准液润洗碱式滴定管;
B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
参考答案:⑴Ag++ H2O 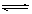 AgOH +H+ 抑制
AgOH +H+ 抑制
⑵OH-、H+、NH4+、Cl- c(Cl-)=c(NH4+)>c(H+)=c(OH-) >
⑶AB
本题解析:(1)银离子在水溶液中可发生水解,有氢离子生成,所以溶液显酸性。硝酸中会存在大量的氢离子,所以可以抑制硝酸银的水解(2)产物是氯化铵和水,所以溶液中会存在氢氧根离子、氢离子、铵根离子、氯离子。主要产物是氯化铵,而铵根离子会发生水解生成氢氧根离子,而从题意可知溶液呈中性,所以排序为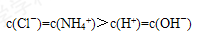
考点:盐类水解相关知识的应用
本题难度:一般
5、填空题 常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
参考答案:(11分) (1)MOH=M+ + OH-(若写可逆号扣1分)(2分)
(2)碱(1分) A- + H2O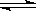 HA + OH-(2分) > (1分)
HA + OH-(2分) > (1分)
(3)[M+] = [A-]>[H+]=[OH-] (2分)
(4) = (2分) 0.05 + 10-11 (若只写0.05不得分)(2分)
本题解析:(1)根据图像可知,当加入13mlHA时,HA是过量的,但溶液显中性,这说明MOH一定是强碱,而HA是弱酸,则MOH在水溶液中的电离方程式为MOH=M+ + OH-。
(2)由于HA是弱酸,MOH是强碱,则MOH与HA恰好完全反应时,生成的MA水解,溶液呈碱性,水解方程式是A- + H2O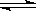 HA + OH-。HA是弱酸,抑制水的电离,而水解促进水的电离,所以混合溶液中由水电离出的c(H+)>0.2 mol/L HA溶液中由水电离出的c(H+)。
HA + OH-。HA是弱酸,抑制水的电离,而水解促进水的电离,所以混合溶液中由水电离出的c(H+)>0.2 mol/L HA溶液中由水电离出的c(H+)。
(3)B点溶液显中性,则根据电荷守恒可知[M+]=[A-]>[H+]=[OH-]。
(4)D点溶液中的溶质是MA和HA,且二者的浓度是相等的,所以根据物料守恒可知,c(A-)+c(HA)=2 c(M+)。有电荷守恒可知c(A-)+c(OH-)=c(M+)+c(H+),则c(HA) + c(H+)=c(OH-)+ c(M+)=10-11+0.05。
考点:考查弱电解质的电离、盐类水解、溶液中离子浓度大小比较和有关计算
点评:该题是中等难度的试题,试题贴近高考,综合性强,试题基础性强,侧重能力的培养和解题方法的指导,主要是考查学生分析和解决问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。该题的关键是明确溶液中离子的几种守恒关系,即电荷守恒、物料守恒及质子守恒。
本题难度:困难