时间:2017-09-23 22:43:58
1、选择题 已知SO3、BF3、CCl4、PCl5、SF6都是非极性分子,而H2S、NH3、NO2、SF4、BrF5都是极性分子,由此可推出ABn型分子属于非极性分子的经验规律是( )
A.ABn型分子中A、B均不含氢原子
B.A元素的相对原子质量必小于B元素的相对原子质量
C.分子中所有原子都在同一平面上
D.ABn型的价层电子对数等于n
2、填空题 (10分)A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是?。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是?键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有?、?(分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是?。
a.氢化物稳定性:B>C? b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C?d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为?(用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为?。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为?,该物质的晶体属于?。
3、选择题 下列化学用语书写不正确的是( )
A.氯离子的结构示意图: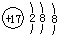
B.乙烯的结构简式:CH2=CH2
C.氯化镁的电子式: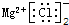
D.苯的化学式:C6H6
4、选择题 下列化合物中含有离子键的是( )
A.CO2
B.H3PO4
C.CH3COOH
D.NaCl
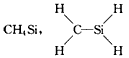
5、选择题 下列化学式对应的结构式从成键情况看不合理的是
[? ]
A.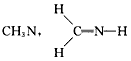
B.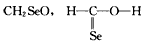
C.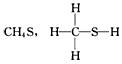
D.