时间:2017-09-23 22:28:36
1、简答题 根据元素周期表1-20号元素的性质和递变规律,回答下列问题.
(1)属于金属元素的有______种,金属性最强的元素与氧反应生成的具有强氧化性的化合物有______(填化合物的化学式).
(2)属于第三周期的稀有气体的是______(填元素符号,下同);
(3)第三周期中,原子半径最大的是(稀有气体除外)______;
(4)推测Si、N最简单氢化物的稳定性______大于______(填化学式,该题3分,其它均2分)
2、选择题 W粒子的结构示意图如图所示,下列关于它的说法不正确的是 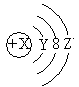
[?]
A.Y=2
B.若X=18,则Z=8
C.若X=11,它的氧化物化学式为W2O
D.若X=15,它属于金属元素的原子
3、选择题 前三周期元素x,y的原子序数相差2,下列叙述正确的是
[? ]
A.x与y不可能位于同一主族
B.x与y一定位于同一周期
C.x与y可能形成共价化合物xy
D.x与y不可能形成离子化合物xy
4、简答题 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 ② ③ ④ 3 ⑤ ⑥ ⑦ ⑧ | ||||||
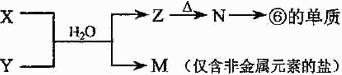
5、选择题 按电子排布,可把周期表里的元素划分成5个区,以下元素属于p区的是
A.Fe
B.Mg
C.P
D.Zn