时间:2017-09-23 22:27:15
1、填空题 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答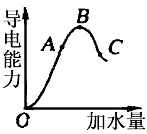
(1)“O”点导电能力为“0”的理由是 __________________________________。
(2)A.B.C三点pH值由大到小的顺序是 _______________________。
(3)A.B.C三点电离程度最大的是_________。
参考答案:(1)冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,不电离,则不导电
(2)C>A>B
(3)C
本题解析:
本题难度:一般
2、选择题 将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是
[? ]
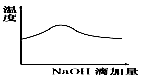
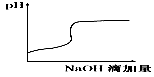
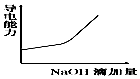
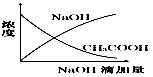
参考答案:D
本题解析:
本题难度:一般
3、选择题 常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是( )
A.若c(OH-)>c(H+),则a=b
B.若c(K+)>c(CH3COO-),则a>b
C.若c(OH-)=c(H+),则a>b
D.若c(K+)<c(CH3COO-),则a<b
参考答案:D
本题解析:若a=b,则溶质为醋酸钾,c(K+)>c(CH3COO-),c(OH-)>c(H+);
若a>b,则溶质为醋酸和醋酸钾,溶液可能呈酸性,c(OH-)<c(H+),c(K+)<c(CH3COO-);也可能呈中性,c(OH-)=c(H+),c(K+)=c(CH3COO-);也可能呈碱性,c(OH-)>c(H+),c(K+)>c(CH3COO-);
若a<b,则溶质为醋酸钾和氢氧化钾,溶质呈碱性,c(OH-)>c(H+),c(K+)>c(CH3COO-)。
考点:酸碱中和
点评:分类讨论思想的应用。
本题难度:困难
4、选择题 醋酸在水溶液中存在下列电离平衡:CH3COOH CH3COO-- +H+?下列说法不正确的是:
CH3COO-- +H+?下列说法不正确的是:
A.加入醋酸钠,平衡向左移动,
B.加入碳酸钠,平衡向右移动
C.加水稀释,C(H+)减小
D.加水稀释,溶液中仅有的三种离子浓度都减小。
参考答案:D
本题解析:略
本题难度:一般
5、选择题 常温下,用0.1000mol/L?NaOH溶液分别滴定20.00mL?0.1000mol/L?盐酸和20.00mL?0.1000mol/L?醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为?c(Na+)=c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0?mL<V(NaOH)<20.00?mL时,对应混合溶液中各离子浓度由大到小的顺序均为?c(A-)>c(Na+)>c(H+)>c(OH-)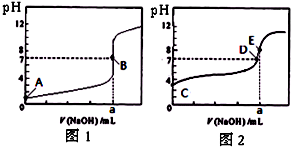
参考答案:B
本题解析:
本题难度:一般