时间:2017-09-23 22:26:34
1、选择题 两份铝屑,第一份与足量的稀盐酸反应,第二份与足量的氢氧化钠溶液反应,产生氢气的体积比为1:2(同温同压下),则两份铝屑的质量比为
[? ]
A.1:1
B.1:2
C.1:3
D.1:4
2、填空题 盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有_________?性。用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有____________性。
(2)①在100mL?18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是?______________。 ?
?A.40.32L?B.30.24L?C.20.16L?D.13.44L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式_____________?。
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反?应的化学方程式为______________?。
(4)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出溶液呈“绿色”可能是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)______________。
3、计算题 氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据题意完成下列计算: (1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式______。该氢化物受撞击则完全分解为氮气和氢气。4.30g该氢化物受撞击后产生的气体在标准状况下的体积为__________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。 由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为 6NO+4NH3=5N2+6H2O;6NO2+8NH3=7N2+12H2O,NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气。吸收后氨水密度为0.980 g/cm3。
计算:①该混合气体中NO与NO2的体积比。②吸收后氨水的物质的量浓度(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物: 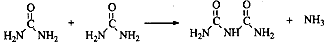
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比。
4、填空题 在已平衡的天平的两个托盘上各放一个等质量的烧杯,分别装入1 mol.L-1的盐酸100 mL,再分别加入xg NaHCO3和)yg KHCO3固体,要使反应后天平仍保持平衡,计算下列情况中x、y的关系:
(1)当y<10,x<8.4时,________。
(2)当x>8.4,y<10时,________。
(3)当x>10,y>10时,_________。
5、计算题 有一定质量的Zn与100 mL 18.5 mol·L-1的浓硫酸充分反应,Zn完全溶解,同时生成标准状况下的气体A
33.6 L,将反应后的溶液稀释到1 L,测得溶液中H+的浓度 为0.1 mol·L-1。求气体A中各组分的体积比。