时间:2017-09-23 22:24:51
1、选择题 将一定量A、B装入容积为1 L的恒温密闭容器中,发生反应:2A(g)+bB(g)  cC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的
cC(g),1 min时达到平衡,C的浓度为x mol·L-1。若保持温度不变,将密闭容器的容积压缩为原来的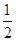 ,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是? ( )
,重新达到平衡后,C的浓度为2.5 x mol·L-1,下列说法正确的是? ( )
A.化学计量数的关系:b<c
B.容器的容积减小后,该反应的逆反应速率减小
C.原容器中用B的浓度变化表示该反应在1 min内的速率为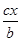 mol·(L·min)-1
mol·(L·min)-1
D.若保持温度和容器的容积不变,充入氦气(不参与反应),平衡不发生移动
参考答案:D
本题解析:由题意可知,压强增大,平衡向正反应方向移动,所以b+2>c,但得不出b和c的相对大小关系,A项错;容器的容积减小后,正、逆反应速率都增大,B项错;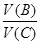 =
=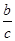 ,v(B)=
,v(B)=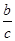 ·v(C)=
·v(C)=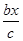 ?mol·(L·min)-1,C项错。
?mol·(L·min)-1,C项错。
本题难度:一般
2、选择题 如图所示是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )。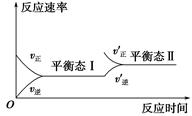
A.反应达到平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增加反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
参考答案:C
本题解析:本题考查化学反应速率和化学平衡知识,当平衡时,各物质的量随时间的变化应不再发生变化,故是平行于横坐标的直线,由平衡态Ⅰ变为平衡态Ⅱ,可通过增大反应物浓度的方法实现。从题中图像可知,新平衡反应速率大于原平衡反应速率,所以不可能是减小反应物的浓度,所以C项叙述与示意图不相符合。
本题难度:一般
3、填空题 (12分)随着氮氧化物污染的日趋严重,我国将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法:
(1)用活性炭还原法处理氮氧化物。有关反应为:C(g)+2NO(g) N2(g)+CO2(g)?△H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
N2(g)+CO2(g)?△H.某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时刻测得各物质的浓度如下:
| ?浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |

参考答案:(1)①0.56?②减少CO2的浓度(其他合理答案均可)③<
(2)CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(l)?△H=-955kJ.mol-1
(3)CD? (4)NO2+NO3—-e-=N2O5
本题解析:(1)①根据表中数据可知,平衡常数为 。
。
②根据数据变化可知,NO浓度减小,氮气浓度增加,CO2浓度减小,说明平衡向正反应方向移动,所以改变的体积是减小CO2的浓度。
③原容器中的NO、N2、CO2的浓度之比为4:3:3,这说明升高温度平衡向逆反应方向移动,因此正反应是放热反应。
(2)考查盖斯定律的应用,(①+②+③×4)÷2即得到
CH4(g)+2NO2(g)==N2(g)+CO2(g)+2H2O(l),所以反应热是
(―574kJ.mol-1―1160kJ.mol-1―-44.0kJ.mol-1×4)÷2=-955kJ.mol-1。
(3)(3)催化剂不能改变平衡状态,A不正确。选项B中反应速率的反应相同,始终成立,B不正确。正反应是放热反应,所以升高温度平衡向逆反应方向移动,平衡常数减小,C正确。该反应是体积增大的可逆反应,选项D相当于增大压强,所以平衡向逆反应方向移动,转化率降低,D正确,答案选CD。
(4)根据装置图可知石墨Ⅱ通入氧气,是正极,所以石墨I是负极,失去电子,反应式为NO2+NO3—-e-=N2O5。
本题难度:一般
4、填空题 (8分) A(g)+2B(g)  2C(g)的反应中,时间t与C的体积分数(C%)的函数关
2C(g)的反应中,时间t与C的体积分数(C%)的函数关
系如图所示。回答下列问题:
(1)图A中若两条曲线分别表示在100℃和400℃时的C%与时间t的函数关系,则P表示的温度为?℃,
从P、Q分析反应A(g)+2B(g)  2C(g)是?反应(填“吸热”或“放热”);
2C(g)是?反应(填“吸热”或“放热”);
(2)图B中P表示的温度为?℃,反应A(g)+2B(g)  2C(g)是?反应(填“吸热”或“放热”)。
2C(g)是?反应(填“吸热”或“放热”)。
参考答案:(1)400℃?吸热(2)100℃?放热
本题解析:(1)温度高,反应速率快,达到平衡的时间少,P曲线首先达到平衡状态,所以P表示400℃。温度高,C的含量也高,说明升高温度,平衡向正反应方向移动,所以正反应是吸热反应。
(2)根据图像可知,Q曲线首先达到平衡状态,所以Q表示的是400℃,因此P表示的是100℃。温度低,C的含量高,说明降低温度,平衡向正反应方向移动,所以正反应是放热反应。
本题难度:一般
5、简答题 (1)在一定条件下,容积为100L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
将1.0molCH4和2.0molH2O(g)通入该密闭容器l0min时有0.1molCO生成,则10min内该反应的平均速率v(H2)______.
(2)在压强为0.1MPa条件下,容积为VL某密闭容器中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);CO的转化率与温度、压强的关系如图所示.
①该反应的△H______(填“<”、“>”或“=”).
②100℃时该反应的平衡常数K=______(用含a、V的代数式表示).
③在温度容积不变的情况下,向该密闭容器再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”),平衡常数______(填“增大”、“减小”或“不变”).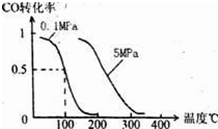
参考答案:(1)l0min时有0.1molCO生成,所以v(CO)=0.1mol100L10min=0.0001mo1?L-1?min-1.速率之比等于化学计量数之比,所以v(H2)=3v(CO)=3×0.0001mo1?L-1?min-1=0.0003mo1?L-1?min-1.
故答案为:0.0003mo1?L-1?min-1.
(2)①由图可知,压强不变,温度越高CO的转化率越低,故温度升高平衡向逆反应方向移动,升高温度平衡向吸热反应方向移动,所以正反应为放热反应,即△H<0.
故答案为:<.
②100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
对于反应 CO(g)+2H2(g)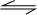 CH3OH(g);
CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a0.5a
平衡(mol):0.5a a 0.5a
所以平衡时 CO的浓度为0.5amolvL=a2vmol/L,H2的浓度为amolvL=avmol/L,CH3OH的浓度为0.5amolvL=a2vmol/L.
100℃时该反应的平衡常数k=c(CH3OH)c(CO)?c2(H2)=a2va2v×(av)2=v2a2.
故答案为:v2a2.
③温度容积不变,向该密闭容器再增加amolCO与2amolH2,等效为开始加入2amolCO与4amolH2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大.
平衡常数只受温度影响,温度不变,平衡常数不变.
故答案为:增大;不变.
本题解析:
本题难度:简单