时间:2017-08-26 03:28:00
1、实验题 饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究。
实验一:定性研究。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色退去;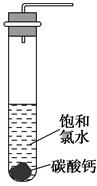
②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性比氯水强的原因是?。
(2)依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有?(填写溶质的化学式)。
实验二:定量研究。
在圆底烧瓶底部,用一塑料网包住块状石灰石(过量)与150 mL饱和氯水反应,按下图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,将装置密封后再加热,煮沸烧瓶中的液体,量筒中的气体不再增加时停止实验。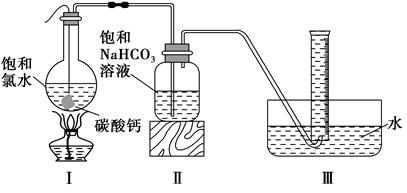
请回答:
(3)实验结束后检测到量筒中收集到的气体除CO2外还有O2,请写出Ⅰ中产生O2的化学反应方程式?。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,请你对装置Ⅲ进行改进(水槽中仍为水),最简单的方法是?。
参考答案:(1)CaCO3消耗了氯水中的盐酸,使可逆反应Cl2+H2O HCl+HClO的平衡向右移动,HClO浓度增大
HCl+HClO的平衡向右移动,HClO浓度增大
(2)Ca(HCO3)2
(3)2HClO 2HCl+O2↑
2HCl+O2↑
(4)将水槽中的水换为热水(答案合理即可)
本题解析:(1)由于次氯酸的酸性弱于碳酸的酸性,但强于HCO3-的酸性,所以碳酸钙只与盐酸反应,与氯水中的次氯酸是不反应的。即CaCO3消耗了氯水中的盐酸,使可逆反应Cl2+H2O HCl+HClO的平衡向右移动,HClO浓度增大,所以漂白性增强。
HCl+HClO的平衡向右移动,HClO浓度增大,所以漂白性增强。
(2)第一份滤液与石灰水混合,立即产生大量白色沉淀,第二份与稀盐酸混合,立即产生大量CO2,因此可以判断白色沉淀是碳酸钙,所以滤液中还存在的溶质是碳酸氢钙。
(3)次氯酸不稳定,受热易分解生成氧气和氯化氢,反应方程式为2HClO 2HCl+O2↑。
2HCl+O2↑。
(4)气体的溶解度随温度的升高而降低,所以要减小CO2溶解带来的损耗,可以将水槽中的水换为热水。
本题难度:一般
2、实验题 (10分) 无水CuSO4在强热下会发生分解反应:
CuSO4 CuO + SO3↑
CuO + SO3↑
2SO3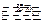 2
2 SO2↑+ O2↑
SO2↑+ O2↑
某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。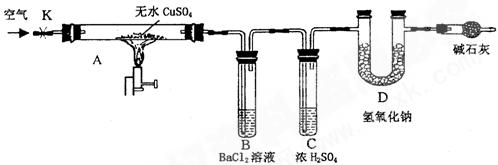
实验步骤:
①称量反应前D 管的质量。
管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热 。
。
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1)B管中出现的现象是__________________________________________________。
有关离子方程式是__________________________________________________
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是______________________
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?___________
原因是__________________________________________________________。
参考答案:(1)有气泡冒出,产生白色沉淀,且明显放热(2分)
SO3 + H2O + Ba2+= BaSO4↓+ 2H+
或SO3 + H2O = 2H++SO42-, SO42- + Ba2+= BaSO4↓(4分)
(2) SO3溶于水放热(2分)
(3)不能(2分),SO3不能完全分解为SO2和O2, 且部分SO2会溶解在溶液中(4分)
本题解析:略
本题难度:简单
3、实验题 (共17分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: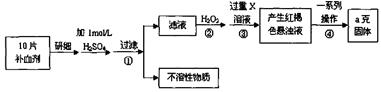
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加?,该过程的现象为:?。
(2)步骤②加入过量H2O2的目的:?。
(3)步骤③中反应的离子方程式:?。
(4)步骤④中一系列处理的操作步骤:过滤、?、灼烧、?、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量?g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需?。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是?。
a.稀硝酸? b.稀硫酸? c.稀盐酸? d.浓硝酸
③滴定到终点时的现象描述为? ________________
参考答案:(1)H2O2或氯水?滴加KSCN溶液不变色,再滴加H2O2(或氯水)后,溶液变红色(每空2分)
(2)将Fe2+氧化成Fe3+?(2分)
(3)Fe3++3OH-=Fe(OH)3↓或Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+(2分)
(4)洗涤、冷却(每空1分)
(5)0.07a?(2分)
(6)①250mL容量瓶?(2分)?② b?(1分)?
③滴入一滴KMnO4溶液,恰好变为紫红色,且半分钟内不褪色(或不恢复原色) (2分)
本题解析:本实验是通过将补血剂研碎,加入H2SO4溶解,通过过滤,将不溶物除去,而此时的溶液中,铁元素以Fe2+的形式存在,因为不稳定,所以加入强氧化剂H2O2将之氧化成Fe3+,接着加入过量的碱,生成Fe(OH)3的红褐色沉淀,经过过滤、洗涤、灼烧、冷却,将得到红棕色的Fe2O3粉末来测定铁元素的含量。
(1)证明滤液中有Fe2+,可以通过加入KSCN溶液,没颜色变化,再加入强氧化剂,像氯水、过氧化氢等将之氧化,此时溶液变成血红色来证明。
(2)因为Fe2+不稳定,所以常常通过加氧化剂把它氧化成稳定的Fe3+。
(3)Fe3+与碱反应,有两种形式,一种是和强碱反应,则Fe3++3OH-=Fe(OH)3↓,一种是和弱碱氨水反应,则Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+。
(5)FeSO4·7H2O中的铁元素最终是形成Fe2O3,
即2FeSO4·7H2O~Fe2O3
556? 160
X?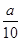
则X=0.35a,即每片补血剂中含FeSO4·7H2O(0.35a) g,则每片含铁元素的质量为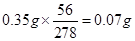
(6)①因为要配置250ml的KMnO4溶液,故需要250ml的容量瓶,注意,常用的容量瓶有100ml、250ml、500ml和1000ml。
②加入的酸,尽量避免引入新的杂质,故选稀硫酸。
③Mn2+是无色,MnO4—是紫红色,判断到达终点的依据是滴入一滴KMnO4溶液,恰好变为紫红色,且半分钟内不褪色。2+和Fe3+相关性质的考核。
点评:本题考查了有关Fe2+和Fe3+的性质,要求学生掌握Fe2+和Fe3+的检验以及铁的重要化合物间的转化,除此,还要认识到一些实验室中的常识,如容量瓶的使用等。
本题难度:简单
4、实验题 为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)_____________________________。
供选用试剂:a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案I.取672mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。
方案II.向VmL?c?mol/L酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色。
方案III,取VL(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg。
①其中不合理的方案是______________,理由是_____________________。
②选择合理方案的数据计算气体Y中SO2的体积分数________(用含未知数的代数式表示。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持装置已省略)。 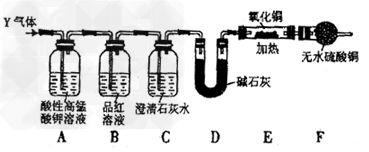
(3)装置A中试剂的作用是____________________。
(4)简述确认气体Y中含有CO2的实验现象:_____________________。
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠?_______(填“可靠”或“不可靠”),简述理由:____________________。
参考答案:(1)取少量X溶液装于试管,向试管中滴加酸性高猛酸钾溶液,若溶液褪色,则证明X溶液中含有Fe2+,否则不含Fe2+
(2)①方案III;生成BaCO3和BaSO4两种沉淀,无法计算SO2的体积;②66.7%(或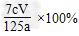 )
)
(3)吸收并除去SO2
(4)B中品红溶液不褪色,C中澄清石灰水变浑浊
(5)不可靠;空气中的水蒸气进入F装置,也可使无水硫酸铜变蓝色
本题解析:
本题难度:一般
5、实验题 欲在室温和1.01×105 Pa条件下测定镁的相对原子质量。请利用下图给定的仪器中选择合适的仪器组成一套实验装置(每仪器只允许用一次)。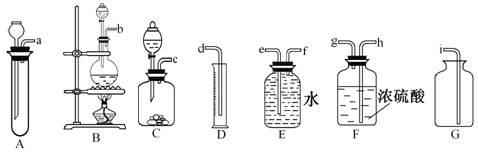
请回答下列问题:
(1)假设气流方向为左→右,则所选各仪器的接口连接顺序为(用小写字母填写):
_________________________________。
(2)连接好仪器后,要进行的操作有以下几步:
①待反应容器中的物质恢复至室温时,测量出气体体积折合到标准状况下为V mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为m g);
③检查各装置的气密性;
④往反应容器内加入某稀酸,至镁条不再溶解。
上述几步操作的先后顺序是?。
(3)根据实验数据可算出镁的相对原子质量,其数学表达式为____________________。
(4)若未将反应容器冷却至室温就测量气体体积,这将会使所测镁的相对原子质量数据(填“偏高”、“偏低”、“无影响”)_______________。
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(填“偏高”、“偏低”、“无影响”)__________________。
参考答案:(2分×5=10分)
(1)c接f、e接d?(2)②③④①(或③②④①)?(3)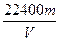
(4)偏低?(5)偏高
本题解析:略
本题难度:简单