时间:2017-08-26 03:10:43
1、选择题 铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL的NO2和336 mL的N2O4气体(标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.0.02 g
B.8.51 g
C.8.26 g
D.7.04 g
参考答案:B
本题解析:因两金属均为+2价金属,可推知每摩尔金属还原HNO3得2 molNO2.所以,两金属总的物质的量为(4 480+336×2)mL/44 800 mL·mol-1=0.115 mol,两种氢氧化物总质量可用金属离子质量加氢氧根离子质量来计算:4.6 g+0.115 mol×2×17 g·mol-1=8.51 g
本题难度:一般
2、选择题 最近我国开始从新疆开发天然气,贯穿东西引至上海的大工程,关于天然气的下列叙述中不正确的是
A.天然气和沼气的主要成分是甲烷
B.改液化的石油气为天然气的燃料燃烧时,应减少进入的空气量或增大进入的天然气量
C.天然气燃烧的废气中,二氧化硫等污染物的含量少
D.天然气与空气混合点燃,不会发生爆炸
参考答案:D
本题解析:由于同体积的汽化的液化石油气比天然气消耗的氧气多,改液化的石油气为天然气的燃料燃烧时,应减少进入的空气量或增大进入的天然气量.此题必须知道液化石油气的主要成分是丙烷、丁烷,并且比较相同体积的耗氧量,而不是相同质量的耗氧量.
本题难度:简单
3、选择题 已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液沸点最高的是
A.0.01mol?L-1的蔗糖溶液
B.0.02mol?L-1的NaCl溶液
C.0.01mol?L-1的CaCl2溶液
D.0.02mol?L-1的酒精溶液
参考答案:B
本题解析:分析:根据溶液中非挥发性溶质的分子或离子数越多,该溶液的沸点就越高,则假设溶液为1L时计算选项中溶质的物质的量来比较即可解答.
解答:A、因1L蔗糖溶液中蔗糖的物质的量为1L×0.01mol/L=0.01mol;
B、因1LNaCl溶液中溶质的离子的总物质的量为1L×0.02mol/L×2=0.04mol;
C、因1LCaCl2溶液溶质的离子的总物质的量为1L×0.01mol/L×3=0.03mol;
D、因酒精是挥发性溶质,且1L溶液中分子的物质的量为1L×0.02mol/L=0.02mol,所以D不符合题意;
显然B中含0.04?mol离子,离子数最多,
故选:B.
点评:本题考察了学生利用信息的能力,利用非挥发性溶质的分子或离子数来判断溶液的沸点高低,学生熟悉物质的量浓度的有关计算是解答的关键,并会判断挥发性物质来解答即可.
本题难度:困难
4、选择题 把a?g铝铁合金粉末溶于足量盐酸中,再加入过量氧化钠溶液后过滤,将沉淀洗涤,干燥、灼烧,得到红棕色粉末的质量仍为a?g,则此合金铝的质量分数为
A.70%
B.30%
C.52.4%
D.22.2%
参考答案:B
本题解析:分析:a?g铝铁合金粉末溶于足量盐酸中,加入过量NaOH?溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.
解答:由铝铁合金粉末溶于足量盐酸中,加入过量NaOH?溶液,过滤后向滤液中通入足量二氧化碳,沉淀为氢氧化铝,则经洗涤、干燥、灼烧,得到的固体粉末是氧化铝,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,则合金中Al的质量分数等于氧化铁中氧的质量分数=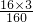 ×100%=30%,
×100%=30%,
故选B.
点评:本题考查混合物的有关计算,难度中等,明确发生的反应找出合金与氧化物的关系是解答本题的关键,注意铁元素的守恒.
本题难度:简单
5、选择题 向15.0mL?1.0mol?L-1的(NH4)Al(SO4)2溶液中逐滴加入1.0mol?L-1的NaOH溶液,并不断搅拌.当生成0.78g沉淀时,所用NaOH溶液的体积可能为
A.30?mL
B.45?mL
C.50?mL
D.65?mL
参考答案:AD
本题解析:分析:向(NH4)Al(SO4)2溶液中逐滴加入NaOH溶液,所发生的反应有:①Al3++3OH-=Al(OH)3↓;②NH4++OH-=NH3↑+H2O;③Al(OH)3+OH-=AlO2-+2H2O,根据发生反应的情况来计算回答.
解答:关于消耗NaOH的反应有三个,反应顺序如下:①Al3++3OH-=Al(OH)3↓;②NH4++OH-=NH3↑+H2O;③Al(OH)3+OH-=(AlO2)-+2H2O,生成的沉淀肯定是Al(OH)3 ,0.78g是0.01mol,有Al3+共0.015mol;当NaOH不足时只发生反应①,则消耗NaOH 0.03mol,体积是30ml,故A正确;当NaOH过量时①②③反应同时发生,则0.015molAl3+全部参加反应,其中0.005mol最终转化成AlO2-,全部的0.015molNH4+变成NH3,所以共消耗NaOH:0.015×3+0.005*×1+0.015=0.065mol,体积是65ml,故D正确.故选AD.
点评:本题考查学生含铝化合物和氢氧化钠之间的反应情况,注意发生反应的先后情况是解题的关键,难度不大.
本题难度:一般