时间:2017-08-26 02:58:55
1、选择题 已知下列热化学方程式:
Zn(S)+1/2O2(g)=ZnO(S)△H1;Hg(l)+1/2O2(g)=HgO(S)△H2;
则Zn(S)+HgO(S)=Hg(l)+ZnO(S)△H值为( ? )
A.△H2-△H1
B.△H2+△H1
C.△H1-△H2
D.-△H1-△H2
参考答案:C
本题解析:
本题难度:一般
2、填空题 常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ/mol)下表是一些键能数据(kJ·mol-1)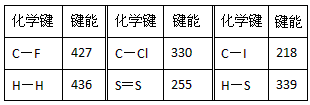
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:_________<C-Br键能<_________
(2)热化学方程式2H2(g)+S2(g) ==2H2S(g) △H= QkJ·mol-1;则Q=___________
(3)已知下列热化学方程式:
O2(g) == O2+(g) +e- △H1= +1175.7 kJ·mol-1
PtF6(g) + e-== PtF6-(g) △H2= -771.1 kJ·mol-1
O2+PtF6-(s) == O2+(g) + PtF6-(g) △H3= +482.2 kJ·mol-1
则反应O2(g) +_________(g) = O2+PtF6-(s)的△H=_____________ kJ·mol-1。
参考答案:(1)218kJ·mol-1;330kJ·mol-1
(2)-229
(3)PtF6;-77.6
本题解析:
本题难度:一般
3、简答题 实验室模拟合成氨和氨催化氧化的流程如下: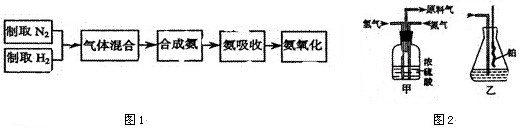
(l)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化钱溶液经加热后反应制取氮气,写出该反应的化学方程式:______.
(2)图中,氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有______.
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨______(“会”或“不会”)发生倒吸,原因是______.
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是______.锥形瓶中还可观察到的现象是:______.
(5)写出乙装置中氨氧化的化学方程式:______.
(6)用CH4催化还原NO2可以消除氮氧化物的污染.例如.
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1,
写出CH4还原NO2至N2的热化学方程式______;若用标准状况下4.48LCH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用N2表示),放出的热量为______kJ.
参考答案:(1)根据质量守恒定律及题干信息可知,反应物是NaNO2和NH4Cl,生成物是N2和H2O和NaCl,用观察法配平即可,反应方程式为:NH4Cl+NaNO2?△?.?NaCl+N2↑+2H2O,故答案为:NH4Cl+NaNO2?△?.?NaCl+N2↑+2H2O;
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体,
故答案为:干燥气体,观察气泡速度,控制氢气和氮气的流速;
(3)氨气的混合气体中含有大量的氮气和氢气,均是难溶于水的气体,不会倒吸,
故答案为:不会;混合气体中含有大量难溶于水的氮气和氢气;
(4)氨的氧化反应是一个放热反应,放出的热使铂丝保持红热,生成的一氧化氮与空气中的氧气化合成二氧化氮,二氧化氮是红棕色气体,故答案为:氨的氧化反应是一个放热反应,放出的热使铂丝保持红热;有红棕色气体产生;
(5)氨的催化氧化反应方程式为:4NH3+5O2催化剂.△4NO+6H2O,故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(6)已知①CH4(g)+4N02(g)═4NO(g)+C02(g)+2H20(g)△H=-574kJ?mol-1,
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160kJ?mol-1,
则反应CH4(g)+2N02(g)═N2(g)+C02(g)+2H20(g)等于12(①+②),
根据盖斯定律,所以反应CH4(g)+2N02(g)═N2(g)+C02(g)+2H20(g)△H=12[(-574kJ?mol-1)+(-1160kJ?mol-1)]=-867KJ/mol,反应CH4(g)+2N02(g)═N2(g)+C02(g)+2H20(g)中,1mol甲烷参加反应转移电子数为8mol,所以标准状况下4.48L极0.2molCH4还原NO2至N2整个过程中转移的电子为1.6mol,电子总数为1.6NA,当转移8mol电子,放出的能量为867KJ,所以转移1.6mol电子放出的能量为173.4KJ,
故答案为:CH4(g)+2N02(g)═N2(g)+C02(g)+2H20(g)△H=-867KJ/mol;1.6NA;173.4.
本题解析:
本题难度:一般
4、选择题 盖斯定律认为能量总是守恒的,化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
己知:①H2O(g)═H2O(l)△H1═Q1kJ?mol-1
②C2H?5OH(g)═C2H?5OH(l)△H2═Q?2?kJ?mol-1
③C2?H5OH(g)+3O2(g)--2CO2(g)+3H2O(g)△H3═Q3kJ?mol-1
若使23g液态酒精完全燃烧,最后恢复到室温,则放出的热量为(kJ)( ? )
A.Q1+Q2+Q3
B.0.5Q?2-0.5Q3-1.5Q1
C.0.5Q1-1.5Q2+0.5Q3
D.0.5(Q1+Q2+Q3)
参考答案:B
本题解析:
本题难度:简单
5、简答题 已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)=CO2(g);△H=-395.41kJ/mol,C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:______.由此看来更稳定的碳的同素异形体为:______.
参考答案:①C(金刚石、s)+O2(g)=CO2(g);△H=-395.41kJ/mol,
②C(石墨、s)+O2(g)=CO2(g);△H=-393.51kJ/mol,
依据盖斯定律①-②得到C(金刚石、s)=C(石墨、s)△H=-1.9KJ/mol;
根据热化学方程式可知金刚石能量高于石墨,石墨更稳定;
故答案为:C(金刚石、s)=C(石墨、s)△H=-1.9KJ/mol,石墨;
本题解析:
本题难度:一般